
题目列表(包括答案和解析)
2.下图是表示气体分子的示意图,图中“○”和“●”分别表示两种不同的原子,其中可能表示氧化物的是
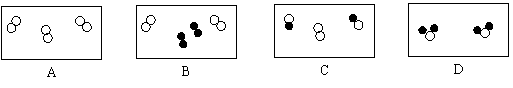
1.物质的运动是永恒的。请你判断下列物质的运动不属于物理变化的是
A.用自来水制蒸馏水 B.从空气中分离制氧气
C.菜刀保管不慎生成铁锈 D.晾干的咸菜表面出现食盐晶体
32. 氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:
氯化钠是一种重要的化工原料,电解氯化钠溶液可制得氯气、氢氧化钠等物质,发生的化学反应如下:
2NaCl+2H2O  Cl2↑+H2↑+2NaOH 现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电。生成氯气的质量与时间的关系如右图所示。请计算:
Cl2↑+H2↑+2NaOH 现取一定质量的溶质质量分数为10%的氯化钠溶液进行电解,当氯化钠完全反应时,停止通电。生成氯气的质量与时间的关系如右图所示。请计算:
(1)参加反应的氯化钠是多少克?生成氢气多少克?
(2)完全反应后所得溶液中溶质的质量分数是多少?(计算结果精确到0.001)
31、香烟燃烧产生的烟气中含有尼古丁(化学式为C10H14N2),会对人体造成伤害。尼古丁中,各元素的质量比为C:H:N = : : ;氮元素的质量分数为 。
30.(8分)小明家购买一瓶白醋,标签上注明醋酸的质量分数≥5%。小明想,这瓶白醋中醋酸的含量是否与标签的标注相符?请你与小明一起,用有关酸碱的知识,定量测定白醋中醋酸含量
实验原理
(1)用已知浓度的氢氧化钠溶液和醋酸反应的化学方程式为:
CH3COOH+NaOH === CH3COONa+H2O
(2)在混合溶液中,当醋酸和氢氧化钠完全中和时,再增加一滴氢氧化钠溶液,溶液就呈碱性,而一滴氢氧化钠溶液约为0.05mL,计算时可忽略不计
实验步骤
①选用 量筒取12mL白醋(密度近似为1.0g/mL)倒入烧杯中,再加入20mL蒸馏水稀释。
A.10mL B.25 mL C.50 mL D.100 mL
②量取45.0mL溶质质量分数为1.0%(密度近似为1.0g/mL)的氢氧化钠溶液,逐滴的滴加到稀释后的白醋中,同时不断搅拌烧杯中的溶液。滴至恰好完全反应,剩余氢氧化钠溶液5.0mL。
数据处理
根据实验数据,计算出白醋中醋酸的含量是 ,与标签的标注 (填相或不相)符。
交流反思
(1)在实验步骤①中,加适量水稀释白醋,对实验结果 (有或无)影响
理由 。
(2)在实验步骤①中量取白醋时俯视,则测定的结果 (填偏高或偏低)
(3)在实验步骤②中,小明确定醋酸和氢氧化钠已恰好完全中和的方法是
。
29.常温常压下1体积水约溶解1体积二氧化碳气体,氢氧化钠溶液与二氧化碳反应时没有明显的现象变化。某研究小组设计了下列实验装置 (所有装置的气密性良好) ,试图通过观察现象来间接证明二氧化碳与氢氧化钠发生了反应。

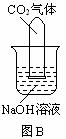

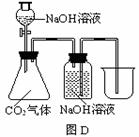
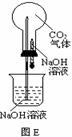
⑴请根据上图实验装置和下表的操作方法,将可能观察到的实验现象填入下表中:
|
所选 装置 |
操作方法 |
实验现象 |
|
A |
将充满二氧化碳的试管倒扣在水中 |
试管内的液面略有上升 |
|
B |
将充满二氧化碳的试管倒扣在氢氧化钠溶液中 |
|
|
C |
将氢氧化钠溶液滴入烧瓶 |
|
|
D |
将氢氧化钠溶液滴入锥形瓶 |
|
|
E |
将胶头滴管中氢氧化钠溶液挤入烧瓶 |
|
⑵若再分别向A、B装置的烧杯中滴入少量氯化钙溶液,将会看到的现象是:
A: ;B: 。
28.探究影响化学反应速率的因素。
(1)发现和提出问题:
化学反应有的很快,如爆炸,有的相当慢,如铁生锈。决定物质之间能否反应以及化学反应速率快慢的内因是反应物的结构和性质。除此以外,催化剂也能改变化学反应速率。
同学们都有这样的生活经验,木炭在氧气中燃烧比在空气中燃烧的旺;这说明反应物的浓度对化学反应速率有影响。夏天,将食品放在冰箱里不容易腐烂;这说明温度对化学反应速率也有影响。那么,温度和浓度是如何影响化学反应速率?
(2)猜想与假设: a.浓度越大,化学反应的速率越快。
b.温度越高,化学反应的速率越快。
(3)收集证据:
实验仪器和试剂:试管、试管夹、酒精灯、药匙、量筒;锌粒、5%盐酸、20%盐酸。
利用上述实验仪器和试剂进行探究,如果假设是a,你认为需要控制的变量有 。
如果假设是b,你认为需要控制的变量有 。
在实验中,通过观测 来判断反应的快慢。
(4)结论与解释:实验证明,条件相同,盐酸的溶质质量分数越大,与金属的反应速率越快。其它条件相同,温度越高,化学反应的速率越快。从反应物的微观粒子相互作用的角度,你认为其原因分别是
_______ ;__________________ 。
(5)交流与反思:通过实验探究我们知道,我们可以通过控制反应条件来控制化学反应的快慢。请你再举出一个通过控制化学反应条件来控制化学反应快慢的事例。
27.围绕一瓶Na0H固体是否变质的问题,同学们展开探究活动。查阅资料:Na0H变质生成Na2CO3;NaCO3溶液的pH>7。
甲同学用酚酞试液检验NaOH是否变质。你认为他能否成功 ,理由是 。
乙同学取少量固体于试管中,滴加某种试剂,有大量气泡产生,由此证明NaOH已经变质。你认为所加试剂为 。
丙同学欲证明变质的固体中尚存NaOH,请你帮助他完成以下探究方案。
|
探究目的 |
探究步骤 |
预计现象 |
|
目的: |
(1)取少量固体溶于水,向其中滴加足量的 液 |
产生白色沉淀 |
|
证明固体中存在NaOH |
(2)向(1)所得溶液中滴加酚酞试液 |
酚酞试液变红 |
26.实验室常用大理石和稀盐酸反应来制取二氧化碳。
(1)反应的化学方程式为 ;
(2)下图所示的仪器中,仪器D的名称为 ;
(3)请你从下图所示的仪器中选择适当的仪器,组装一套实验室制取二氧化碳的装置(包括发生装置和收集装置,填写仪器的编号) ;
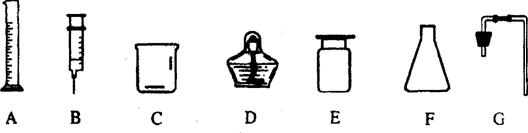
(4)检验产生的气体是否是二氧化碳的方法是 。
25.(1)目前,化石煅烧是人类生产、生活的主要能源。随着全球能源使用的增长,化石燃料等不可再生能源将日趋枯竭。世界各国人民的节能意识正在日趋增强,科学家也在开发新能源、研制节能产品、提高化学能的转化效率等方面,做着积极的努力。下列是目前正在利用和正在开发的部分能源:煤、石油、天然气、太阳能、风能,潮汐能,氢气、
“可燃冰"等。回答下列问题:
(1)属于不可再生的能源是 。
(2)我国“西气东输"工程输送的能源物质是 。
(3)埋藏于海底,目前开采在技术上还存在很大困难的能源物质是 。
(4)通过非化学反应产生能量的能源是 。
(5)使用电池的过程是将 能转化成电能的过程。目前甲醇汽车已进入我省部分城市。甲醇汽车是利用甲醇(用R表示)燃烧提供的 能,它燃烧的化学方程式为2R+3O2=H2O+2CO2,R的化学式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com