
题目列表(包括答案和解析)
1.酒精燃烧的过程中,发生了能量的转化。下列判断中正确的是 : ( )
A.化学能部分转化为热能 B.电能部分转化为化学能
C.热能部分转化为化学能 D.光能部分转化为化学能
21.(12分)孔雀石和石青是自然界存在的两种碳酸盐类铜矿,它们的化学组成可表示为:
xCuCO3·yCu(OH)2(x、y为正整数且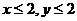 )
)
(1)孔雀石和石青分别与过量盐酸反应时,孔雀石耗用的盐酸的物质的量与生成的CO2的
物质的量之比为4:1;石青则为3:1。请推算它们的化学组成。
孔雀石: ,石青: 。
(2)现有孔雀石和石青混合样品,取两份等质量的样品,在一份中加入过量盐酸,生成CO2 3.36L(标准状况下);加热另一份样品使其完全分解,得到CuO 20g,试通过计算确定该混合物中孔雀石和石青的物质的量之比。
20.(12分)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5 |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
(1)根据表中所给数据分析,同主族内不同元素X值的变化规律是__________________________________;简述元素电负性X的大小与元素金属性、非金属性之间的关系 。
(2)预测周期表中电负性最大的元素应为 ,电负性最小的元素为 (放射性元素除外)估计钙元素的电负性的取值范围 < X < 。
(3)验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型 为 ,其理由是 。
19.(10分)某学生用0.1×10×25㎜3,质量分数≥99.5%的铝片和酸反应制取H2,实验现象见下表:
|
|
1min |
2min |
5min |
15min |
20min |
|
3mol/L HCl |
少量气泡 |
较多气泡 |
大量气泡 |
反应剧烈 |
铝片耗尽 |
|
1.5 mol/LH2SO4 |
均无明显现象(只有少量气泡) |
(1)写出铝片与酸反应的离子方程式 。
(2)反应1-15min内,铝与盐酸的反应速率逐渐加快,其原因是
。
(3)根据铝片与盐酸和硫酸反应现象的差异,深入思考,可作出如下猜想:
猜想一: 。
猜想二: 。
18.(10分)下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格。
 a
a

 b c
b c
|
序号 |
已知情境 |
写出化学式 |
写出对应反应的离子方程式 |
|
(1) |
 已知b溶液中滴入KSCN溶液后,溶液呈血红色。 |
a |
①_______
_____ ②___ _________ |
|
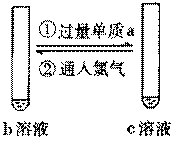
(2) |
 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5。 |
a_________ b_________ c_________ |
④_____
_____ |
17.(14分)我国化工专家候德榜的“候氏制碱法”曾为世界制碱工业做出突出贡献。他利用NaHCO3、NaCl、NH4Cl等物质溶解度的差异,以食盐、氨气、CO2为原料先制得NaHCO3,进而生产出纯碱。下面是在实验室中摸似“候氏制碱法”中制取NaHCO3实验步骤:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让一装置发生反应,直到产生的气体不能再在C中溶解时,再通入另一装置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:过滤C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的NaCl粉末,有NH4Cl晶体析出。
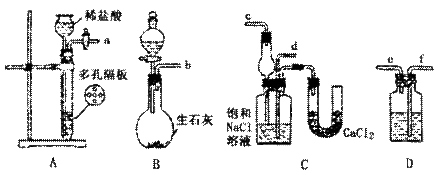
请回答下列问题:
(1)装置的连接顺序是:(a)接( )( )接( ),(b)接( )
(2)A中常选用的固体反应物为 ,D中应选用的液体为 。
B中发生反应的化学方程式为 。
(3)第二步骤中必须先让 装置先发生反应。
(4)C中用球形干燥管而不用直导管,其作用是 ,C中广口瓶内产生固体的总化学方程式为 。
(5)第四步中分离出NH4Cl晶体的操作是 ;其所得的NH4Cl晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单的实验证明所得固体的成分大部分是NH4Cl。简要写出操作和现象:
16.(12分)无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝露置于潮湿空气中会爆炸并产生大量白雾,工业上由金属与氯气作用或由无水氯化氢气体与熔融Al作用而制得,某课外活动小组在实验室内通过下列装置(如下图)制取少量纯净的无水氯化铝。
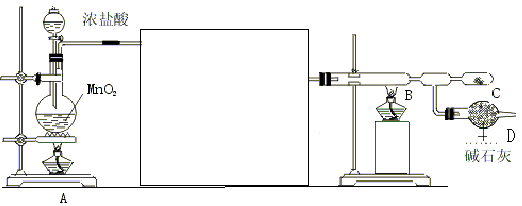
试回答以下问题:
(1)装置A中反应的化学方程式 。
(2)为使实验成功,A和B间需要加适当的装置,请将它画在框内,并注明其中盛放的药品。如果A产生的气体直接进入B中,实验产生的不良后果是
(3)进行实验时,应先点燃(填写字母,下同) 处的酒精灯,然后再点燃
处的酒精灯。
(4)在C处可以收集到纯净的氯化铝,原因是
(5)装置D的作用是
15.下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
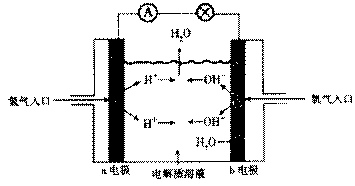
A. b电极是正极
B. 总反应方程式为:2H2+O2=2H2O
C. 负极发生还原反应,正极发生氧化反应
D. 氢氧燃料电池是一种具有广泛应用前景的绿色电源
卷II(70分)
14.下列关于实验室制取气体所用试剂的组合不合理的是
A.制Cl2: MnO2、盐酸(浓) B.制H2:硫酸(稀)、Zn
C.制O2: MnO2、H2O2 D.制CO2:硫酸(稀)、CaCO3
13.在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是
A.2Na +2H2O = 2NaOH + H2↑
B.SO2+2H2S = 3S+2H2O
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
D.Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3·H2O+6H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com