
题目列表(包括答案和解析)
4、据报道,美国在研究用锌电池取代目前广泛使用的蓄电池,它具有容量大、污染小的特点其电池反应为:2Zn + O2 = 2ZnO,其原料为锌、空气和电解质溶液,则下列叙述正确是 ( )
A. 锌为正极,空气为负极反应
B. 负极还原反应,正极氧化反应
C. 负极的电极反应为:Zn - 2 e- + 2OH- = ZnO + H2O
D. 电池工作时溶液的pH降低
3、电子表和电子计算器的电源通常用微型银-锌电池,其电极分别为Ag2O和Zn,电解质为KOH溶液,电极总反应为:Ag2O + H2O + Zn = Zn(OH)2 + 2Ag.下列叙述正确的是( )
A.Zn是正极, Ag2O是负极 B.Zn是负极, Ag2O是正极
C.工作时负极区溶液的pH增大 D.工作时电子由Ag2O极经外电路流向Zn极
2、Li-Cd池在现代生活中有广泛应用,它的充放电反应按下式进行:
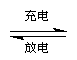
Cd(OH)2 + 2Ni(OH)2 Cd + 2NiO(OH) + 2H2O
由此可知,该电池放电时的负极材料是 ( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
1、随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是 ( )
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其它物品
D.回收其中石墨电极
2、(海水电池)1991年我国首创以铝-空气-海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水中数分钟,就会发出耀眼的白光,其总反应方程式为:4Al + 3O2 + 6H2O = 4Al(OH)3,则该电源的负极材料为 ,正极材料为 ,负极反应
正极反应 。
解析:Al 、O2(空气)之间的氧化还原反应为:4Al + 3O2 = Al2O3.将该反应与原电池原理、铝的导电性等知识进行综合分析可知,铝既是负极产物,又是反应材料,O2是正极反应物,正极材料应该选择还原性比铝弱的导电性强的材料,如石墨等
铝、O2的氧化反应、还原反应分别为:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
答案:铝 石墨 负极反应:Al – 3e- = Al3+,O2 + 2H2O + 4e- = 4OH-
[随堂检学]
1、银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可表示为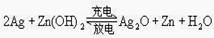 ,
,
此电池放电时,负极上发生反应的物质是 ( )
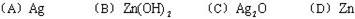
解析:因为放电发生Ag2O + Zn + H2O = 2Ag + Zn(OH)2的反应,负极失去电子,发生氧化反应,做还原剂,因此负极为Zn,答案为D
化学电源有一次电池和二次电池之分,一次电池用过后不能复原,二次电池充电后能继续使用。一次性干电池中的氧化还原反应是不可逆的,放完电之后就不能再使用;而蓄电池中的氧化还原反应是可逆的,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使生成物恢复原状。
2. 在氢氧燃料电池中(KOH溶液做电解质溶液),氢气在 极发生 反应,电
极反应式为 ;氧气在 极发生 反应,电极反应式为 。
1.常见化学电池有 电池、 电池、 电池、 电池、
电池、 电池。
15、用惰性电极电解1L4mol/LCuSO4溶液时,在电路通过0.5mol电子,又将电源与电极反接,后又通过1mol电子,求此时溶液中[H+].
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com