
题目列表(包括答案和解析)
12.根据氧化还原反应方程式:2Fe3++Fe==3Fe2+,请将其设计成一个原电池:
(1)电极的负极是 。
(2)可用 等材料作正极。
(3)正极发生的电极反应式是 。
11.如下图所示,烧杯中都盛有稀硫酸。
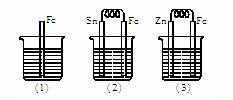
(1)中反应的离子方程式为 。
(2)中的电极反应:Fe: 、 Sn: 。
(3)中被腐蚀的金属是 ,其电极反应式为 。
比较(1)、(2)、(3)中纯铁被腐蚀的速率由快到慢的顺序是 。
10.把a、b、c、d四块金属片浸泡在稀H2SO4中,用导线两两相连可以组成多种原电池:若a、b相连时,a为负极;c、d相连时,c为负极;a、c相连时,c为正极;b、d相连时,b为正极。则这四种金属的活动性顺序由强到弱为( )
A.a>b>c>d B.a>c>d>b
C.c>a>b>d D.b>d>c>a
9.下列几种铁板,在镀层被破坏后,最耐腐蚀的是( )
A.镀锌铁板 B.镀铜铁板
C.镀锡铁板 D.镀铅铁板
8.已知空气-锌电池的电极反应为:
锌片:Zn+2OH--2e-==ZnO+H2O
石墨:O2+2H2O+4e-==4OH-
根据此判断,锌片是( )
A.负极,并被氧化 B.负极,并被还原
C.正极,并被氧化 D.正极,并被还原
7.某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,则该金属可能为( )
A.铝 B.铜 C.锡 D.硅
6.下列关于原电池的叙述中正确的是( )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
5.对铜-锌-稀硫酸组成的原电池装置中,当导线中有1 mol电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g ③铜片上析出 1 g H2 ④铜片上析出1 mol H2
A.①和③ B.①和④ C.②和③ D.②和④
4.在用锌片、铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法正确的是( )
A.锌片是正极,铜片上有气泡产生
B.电流方向是从锌片流向铜片
C.溶液中硫酸的物质的量减小
D.电解液中H+浓度值保持不变
3.关于铜-锌-稀硫酸构成的原电池的有关叙述错误的是( )
A.锌为负极,锌发生氧化反应
B.铜为正极,铜不易失去电子而受到保护
C.负极发生还原反应,正极发生氧化反应
D.外电路电子流入的一极为正极,电子流出的一极为负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com