
题目列表(包括答案和解析)
7. 下列各组中的三种微粒,所含质子数与电子数都相等的是
A. Na+、 Mg2+、 Al3+ B. HCl、H2S、 Ar
C. H2O、OH-、 Na+ D. NH4+、 Na+、F-
6. 下列说法中正确的是( )
①质子数相同的微粒一定属于同一种元素
②电子数相同的微粒不一定是同一种元素
③两个原子如果核外电子排布相同,一定是同一种元素
④质子数相同,电子数也相同的两种微粒,不可能是一种分子和一种离子
⑤所含质子数和电子数相等的微粒一定是原子
⑥同种元素的原子其质量数必相等
A.①②④ B.②③④ C.③④⑥ D.①⑤⑥
5. 已知某种元素的一种原子的核内质子数是m,中子数是n,下列说法正确的是( )
A.该元素的相对原子质量是m+n
B.不能求得该元素的相对原子质量
C.m+n 可写在元素符号的左下角
D.若C-12的质量是w g,则该原子的质量是12(m+n)w g
4. 11g 2H218O所含的中子的物质的量为
A.4.5mol B.5mol C.5.5mol D.6mol
考点2:了解核外电子的排布
3.下列叙述错误的是( )
(A)13C和14C属于同一种元素,它们互为同位素
(B)1H和2H是不同的核素,它们的质子数相等
(C)14C和14N的质量数相等,它们的中子数不等
(D)6Li和7Li的电子数相等,中子数也相等
2.以下互为同位素的是( )
A.金刚石与石墨 B.D2与H2 C.40 19X 与 40 20Y D.35 17Cl与37 17Cl
1.
 是重要的核工业原料,在自然界的丰度很低。
是重要的核工业原料,在自然界的丰度很低。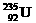 的浓缩一直为国际社会关注。下列有关
的浓缩一直为国际社会关注。下列有关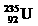 说法正确的是( )
说法正确的是( )
 A.
A.
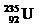 原子核中含有92个中子 B
原子核中含有92个中子 B 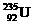 原子核外有143个电子
原子核外有143个电子
C 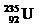 与
与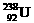 互为同位素 D
互为同位素 D 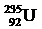 与
与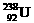 互为同素异形体
互为同素异形体
19.(10分)某元素R的最高价氧化物11.2g,溶于水制得100g碱性溶液,其浓度为14.8%,R原子核内含有20个中子。通过计算,推测R是什么元素,写出推理过程。
18.(8分)周期表前20号元素中,某两种元素的原子序数相差3,周期数相差1,它们形成化合物时原子数之比为1∶2。写出这些化合物的化学式
17.(8分)元素周期表中前7周期的元素如下表所示:
元素周期表中前7周期的元素数目
|
周期数 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
元素数 |
2 |
8 |
8 |
18 |
18 |
32 |
32 |

(1)第6、7周期比第4、5周期多了14种元素,其原因是_____ ___。
(2)周期表中________族所含元素最多,________族元素形成化合物最多。
(3)请分析周期数与元素数的关系,预言第8周期最多可能含有元素种数为_____
A.18 B.32 C.50 D.64
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com