
题目列表(包括答案和解析)
10.CH4(g)+2O2(g)==CO2(g)+2H2O(l) ΔH=-890 kJ·mol-1
9.②③④⑤⑥ ①
1.A 2.C 3.B 4.D 5.A 6.D 7.D 8.B
13.如图所示,把试管小心地放入盛有(20 ℃)碳酸饮料的烧杯中,试管中开始放入几小块镁片,再用滴管滴加5 mL稀盐酸于试管中。试回答下列问题:
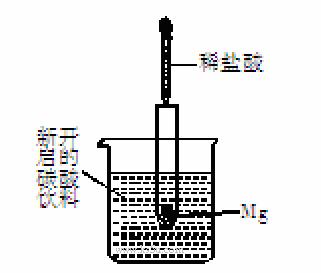
(1)实验中观察到的现象是 。
(2)产生上述现象的原因是 。
(3)写出有关反应的离子方程式 。
(4)由实验推知,MgCl2溶液和氢气的总能量
(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
第二单元 化学反应中的热量
第一课时 化学反应中的热量变化
巩固练习
12.已知下列两个热化学方程式:
H2(g)+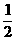 O2(g)==H2O(l)
O2(g)==H2O(l)
ΔH=-285 kJ/mol?
C3H8(g)+5O2(g)==3CO2(g)+4H2O(l)
ΔH=-2 220.0 kJ/mol
(1)实验测得H2和C3H 8的混合气体共5 mol,完全燃烧生成液态水时放热6 264.5 kJ,则混合气体中H2和C3H8的体积比是 。
(2)已知:H2O(l)==H2O(g)
ΔH=+44.0 kJ/mol?
写出丙烷燃烧生成CO2和气态水的热化学方程式。
11.试完成氢气在氧气中燃烧生成水的热化学方程式:
2H2(g)+O2(g)==2H2O(l)
ΔH =-571.6 kJ·mol-1??
H2(g)+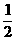 O2(g)==H2O(l)
O2(g)==H2O(l)
ΔH = kJ·mol-1??
H2(g)+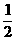 O2(g)==H2O(g)
O2(g)==H2O(g)
ΔH =-241.8 kJ·mol-1
H2(g)+ O2(g)== H2O(g)
ΔH=-483.6 kJ·mol-1?
10.实验室用4 mol SO2与2 mol O2在一定条件下进行下列反应:2SO2(g)+O2(g)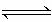 2SO3(g)
2SO3(g)
ΔH =-196.64 kJ/mol,当放出314.624 kJ热量时,SO2的转化率为( )
A.40% B.50% C.80% D.90%
9.管道煤气的主要成分是H2、CO和少量的甲烷。相应的热化学反应方程式为:
2H2(g)+O2(g)==2H2O(l)
ΔH =-571.6 kJ/mol?
2CO(g)+O2(g)==2CO2(g)
ΔH =-566 kJ/mol?
CH4(g)+2O2(g)==CO2(g)+2H2O(l)
ΔH=-890.3 kJ/mol?
当使用管道煤气的用户改用天然气后,在相同条件下燃烧等体积的燃气,理论上所获得的热值后者大约是前者的多少倍( )
A.0.8 B.1.3 C.1.6 D.3.1
8.下列关于燃料充分燃烧的说法,不正确的是( )
A.空气量越多越好
B.应通入适量的空气
C.固体燃料燃烧前要粉碎
D.液体燃料燃烧时可以以雾状喷出
7.已知充分燃烧a g乙炔气体时生成1 mol CO2和液态水,并放出热量b kJ,则乙炔燃烧的热化学方程式正确的是 ( )
A.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)?
ΔH=-4b kJ/mol
B.C2H2(g)+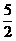 O2(g)==2CO2(g)+H2O(l)
O2(g)==2CO2(g)+H2O(l)
ΔH=2b kJ/mol
C.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)?
ΔH=-2b kJ/mol
D.2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l)?
ΔH=b kJ/mol
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com