
题目列表(包括答案和解析)
(四)卤素的化学性质:
1、卤素单质与氢气的反应
卤素和H2的反应可用通式H2+X2 = 来表示,反应时按F2、Cl2、Br2、I2的顺序,反应条件越来越 ,反应程度依次 ,形成的卤化氢的稳定性也依次 。
2、卤素单质间相互置换反应:
Cl2+ NaBr = ____________________ Cl2+ Br- =_____________________
Cl2+ KI = _______________________________________ Cl2+ I- =_____________________
注意:F2不能置换出NaCl溶液中的Cl2,因为F2在水溶液中发生如下反应:
2F2+ 2H2O = 4HF + O2
自主测试:
1、砹(At)是卤族元素中位于碘后面的元素,试推测砹和砹的化合物最不可能具备性质
A.砹易溶于某些有机溶剂 B.砹化氢很稳定不易分解
C.砹是有色气体 D.砹化银不溶于水或稀HNO3
2、氯化碘(ICl)的化学性质跟氯气相似,预计它与水反应的最初生成物是( )
A. HI和HClO B. HCl和HIO C. HClO3和HIO D. HClO和HIO
3、甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-、I-)离子。向甲中加淀粉溶液和氯水,则溶液变为橙色,再加丙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A、Br-、Cl-、I- B、I-、Br-、Cl- C、Br-、I-、Cl- D、Cl-、I-、Br-
4、(2008四川)下列叙述中正确的是 ( )
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.除点周期外,其他周期均有18个元素
C.副族元素中没有非金属元素 D.碱金属元素是指ⅠA族的所有元素
5.下列说法中正确的是( )
A.周期表是按原子量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同 D.同周期元素的电子层数相同
6.下列说法正确的是( )
A.非金属元素都是主族元素 B.主族元素的次外层电子数都是8
C.稀有气体元素都是主族元素 D.主族元素都是短周期元素
7.在周期表中,同一主族元素化学性质相似。目前也发现有些元素的化学性质和它在周期表中左上方或右下方的另一主族元素性质相似,这称为对角线规则。已知Mg在空气中燃烧,除了生成氧化镁外,还生成氮化镁。据此请回答:
(1)锂在空气中燃烧,除生成________外,也生成微量的________(写化学式)。
(2)铍的最高价氧化物的水化物的化学式是________,属两性化合物,证明这一结论的有关离子方程式为________________、________________。
(3)若已知反应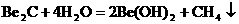 ,则
,则 遇强碱溶液反应的离子方程式为________________________________________________。
遇强碱溶液反应的离子方程式为________________________________________________。
8.在同温同压下,1 mol F2和1 mol I2具有相同( )。
A.体积 B.原子数 C.质量 D.质子数
9.随着核电荷数的递增,氧化性逐渐减弱的一组是 ( )。
A.I2 、Br2 、Cl2 、F2 B. F2 、Cl2 、Br2、I2
C.F- 、Cl- 、Br-、I- D. Li、Na、K、Rb
10.关于碱金属单质的性质叙述错误的是( )。
A.都能够在空气中燃烧 B.都能够与水剧烈反应
C.都是柔软的银白色金属 D.都可以保存在煤油
11.钾和钠的性质相似,下列说法中能最好地解释这个事实的是 ( )。
A.都是金属元素 B.原子半径相差不大 C.最外层电子数相同 D.最高化合价相同
12.天然存在的金属钫(Fr)极微量。已知其21个同位素都有放射性。它是碱金属元素中最重的元素。根据它在周期表中的位置预言其性质,其中不正确的是 ( )。
A.在已知元素中具有最大的原子半径 B.在空气中燃烧时生成氧化物Fr2O
C.氧化物对应的水化物是极强的碱 D.其单质的熔点比金属钠的熔点高
13.随着卤素原子核电荷数的增加,下列递变规律正确的是 ( )。
A.单质的熔沸点逐渐降低 B.气态氢化物的稳定性逐渐降低
C.卤素原子的还原性逐渐增强 D.卤素单质的氧化性逐渐增强
14.卤素单质与氢气都能反应,反应产物是卤化氢(X2+H2=2HX),这是卤素性质的相似性;但其反应条件不同,从“黑暗中即可剧烈爆炸”→“不断加热才能缓慢反应”,这是其性质的递变性。其性质相似性的原因是 ( ), 其性质递变性原因是 ( )。
A.最外层电子数相同 B.都是双原子分子
C.电子层数不同 D.卤化氢中卤素都是-1价
15.(9分)某学校化学兴趣小组欲探究钠、钾与空气中的氧气反应的剧烈程度,并且想利用微型化学实验这种实验手段进行实验。
①[实验用品]玻璃管(直径6-10 mm,长100 mm)、试管夹、小刀、镊子、滤纸、钠、细玻璃棒。还需要哪些实验仪器 。
②[实验方法]学生甲、乙分别用小刀切取黄豆粒大小的一块钠(钾),并用滤纸吸干其表面的煤油,手持玻璃管,将玻璃管口扣压到钠块(或者钾块)上,稍微向下用力,使钠(钾)块进入玻璃管;用细玻璃棒将钠(钾)块推送到玻璃管中间部位;然后用试管夹夹持装有钠(钾)块的玻璃管,在酒精灯火焰上加热钠(钾)块所在部位,直至钠(钾)块时隐时现地燃烧时,则停止加热。可甲、乙两位同学发现钠、钾在空气中燃烧剧烈程度并没有很大差别,请你帮助他们分析实验失败的原因: 。
③[实验改进]学生乙认真分析实验失败的原因后,又重复了上述实验步骤,但在加热至钠(钾)熔化后,立即用洗耳球向玻璃管内鼓入空气,可以观察到玻璃管内的钠(钾)块燃烧,且 比 的燃烧明显的剧烈。
④[思考]你能用其它的实验方法探究钠、钾与空气中的氧气反应的剧烈程度吗?
。

(三)卤素单质的物理性质
颜色:_______________ 状态:________________ 密度:___________________
熔沸点:_______________ 在水中的溶解性:___________________
(二)碱金属的物理性质的比较
相似性:_______________________________________________________________
递变性:_______________________________________________________________
_______________________________________________________________________
(一)碱金属的化学性质
1、与非金属的反应
Li+O2 ________________ Na+O2________________ K+O2______________________________________
K、Rb等碱金属与O2反应,会生成超氧化物。 Rb、Cs在室温时,遇到空气会立即燃烧。
2、与水的反应
K+H2O____________________ Rb+H2O_________________________
除Na、K外,其他碱金属元素也都可以和水反应生成相应的碱与H2。
小结:2M+2H2O == 2MOH+H2↑ 碱性强弱:
思考:根据实验讨论钠与钾的性质有什么相似性和不同。你认为元素的性质与他们的原子结构有关系吗?
________________________________________________________________________
_______________________________________________________________________
17.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的 位置相符的是( )
|
||||||||||||||||||||||||||||||||||||
|
|
|
||||||||||||||||||||||||||||||||||

16.如果发现了原子序数为116的元素,对它的正确叙述是下列组合中的( )
①位于第七周期;②是非金属元素;③最外电子层含有6个电子;④氢化物非常稳定;⑤属于ⅥA元素;⑥属于卤素
A.①③⑤ B.①③⑥ C.②④⑥ D.②③⑤
15.X、Y、Z三种元素原子的核电荷数在11-17之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4,H3ZO4。则下列判断正确的是( )
A.原子半径:X > Y > Z B.酸性:H3ZO4 > H2YO4 > HXO4
C.稳定性:HX > H2Y > ZH3 D.非金属性:Z > Y >X
14.已知a, b, c三种元素原子电子层数相同,a元素氧化物的水化物是强碱,b元素的氧化物的水化物具有两性,c元素的氧化物的水化物是一种强酸,则a, b, c三种元素原子序数由大到小顺序正确的是( )
A.a > b > c B.c > b > a C.b > a > c D.b > c > a
13.A元素的阳离子与B元素的阴离子具有相同的电子层结构,有关两元素有以下叙述:①原子半径A<B;②离子半径A>B;③原子序数A>B;④原子最外层电子数A≤B;⑤A的正价与B的负价绝对值一定相等。其中正确的是( )
A.①② B.③④ C.③⑤ D.③④⑤
12.下图是周期表中短周期的一部分.若X原子最外层电子数目比次外层电子数目少3个,则下列说法中不正确的是( )
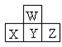
A.X、Y、Z最高价氧化物对应水化物的酸性强弱关系是Z>Y>X
B.X的氢化物比Z的氢化物不稳定
C.X、Y、Z各元素最高正价和最低负价的绝对值的和为8
D.原子半径的大小顺序是Z>Y>X>W
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com