
题目列表(包括答案和解析)
|
类型 |
化学键 |
分子间作用力(范德华力) |
|
相互作用的微粒 |
原子(共价键)离子(离子键) |
分子之间 |
|
作用力强弱 |
强烈 |
微弱 |
|
能量 |
120~800KJ/mol |
几~十几KJ/mol |
|
存在 |
离子晶体、原子晶体、分子内 |
分子晶体中(分子之间) |
|
影响性质 |
主要影响化学性质 |
影响物理性质(熔沸点、硬度) |
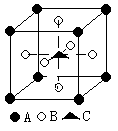
5、某物质的晶体含A、B、C三种元素,其排列方式如图所示,求晶体
中A、B、C的原子个数之比依次为
A 1:3:1 B 2:3:1 C 2:2:1 D 1:3:3


4、下表中给出几种氯化物的熔沸点:
|
|
NaCl |
MgCl2 |
AlCl3 |
SiCl4 |
|
熔点(0C) |
801 |
714 |
190 |
-170 |
|
沸点(0C) |
1413 |
1412 |
180 |
57.57 |
 有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时以能升华②四氯化硅在晶态时属于分子晶体③氯化钠晶体中微粒之间以范德华力结合④氯化铝晶体是典型的离子晶体,其中与表中数据一致的是
有关表中所列四种氯化物的性质,有以下叙述:①氯化铝在加热时以能升华②四氯化硅在晶态时属于分子晶体③氯化钠晶体中微粒之间以范德华力结合④氯化铝晶体是典型的离子晶体,其中与表中数据一致的是
A只有①② B ②③ C 只有①②③ D 只有②④
3、实现下列变化时,需克服相同类型作用力的是
A 水晶(二氧化硅)和干冰的熔化 B 食盐的熔化和碘的升华
C 液溴和碳酸氢铵的气化 D 纯碱和烧碱的熔化
2、能够用键能大小来解释的是
A 氮气的化学性质比氧气稳定 B 常温常压下,溴呈液态,碘呈固态
C 稀有气体一般很难发生化学反应 D 硝酸易挥发,而硫酸难挥发
1、下列过程中,共价键被破坏的是
A 碘升华 B 溴蒸气被活性炭吸收 C 酒精溶于水 D HCl气体溶于水
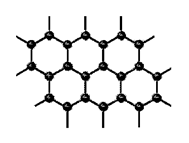
5、石墨的晶体结构:
(1)石墨晶体是_____状结构,层与层之
通过____________相结合,故较软。
(2)同层的碳原子以C-C共价键形成
___________结构,故熔沸点较高。
(3)每个碳原子形成_____个C-C键。
(4)每个正六边形占有______个碳原子,占有_______个C-C键。请计算上图含有______个碳原子。
练习题:
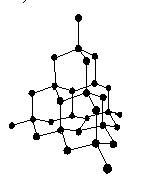
4、金刚石的晶体结构:
(1)每个碳原子形成____个C-C共价键,只存在C-C共价键。
(2)金刚石是由正四面体型的____网状结构;
(3) 键角是__________(4)晶体中最小的碳原子环是由_____个碳
键角是__________(4)晶体中最小的碳原子环是由_____个碳
原子构成的。
3、干冰的晶体结构:
 干冰晶胞中所占有的二氧化碳分子有_____________个,二氧化碳分子周围最近的二氧化碳分子有_________个。
干冰晶胞中所占有的二氧化碳分子有_____________个,二氧化碳分子周围最近的二氧化碳分子有_________个。
2、氯化铯的晶体结构:
(1) 此晶胞中所占有的Cs+的个数为________,Cl-的个数为______
(2)每个Cs+周围有______个Cl-,每个Cl-周围有______个Cs+。
(3)每个Cs+周围最近的Cs+有____个,每个Cl-周围最近的Cl-有___个。
(4)若氯化铯晶体的密度为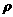 g/cm3,若氯化铯的摩尔质量为Mg/mol
g/cm3,若氯化铯的摩尔质量为Mg/mol
则求Cs+与Cl-之间的距离为______cm,Cl-与Cl-之间的距离为_________cm。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com