
题目列表(包括答案和解析)
3.下列说法中不正确的是 ( )
A.从实验中测得的某种高分子的分子量只能是平均值 B.高分子也可以带支链
C.高分子化合物不溶于任何溶剂 D.高分子化合物一般不导电是因为分子量太大
2.有关高分子化合物的描述中不正确的是 ( )
A.一般具有良好的绝缘性 B.均不耐热,受热后会熔化改变原有的形状
C.大多数合成高分子化合物不溶于水,抗酸碱性能力较强
D.我国航天员穿航天服的袖管使用了高分子材料
例题1。2003年3月,中科院蒋锡夔院士和中科院上海有机化学所计国桢研究员因在有机分子簇集和自由基化学研究领域取得重大成果,而荣获国家自然科学一等奖。据悉,人们在研究过程中曾涉及到如下一种有机物。请根据所示化合物的结构简式回答问题。
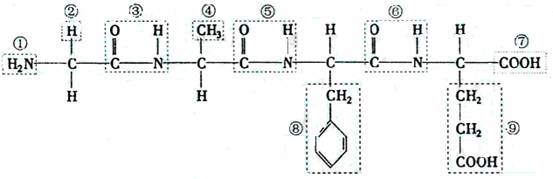
(1)该化合的中,官能团⑦的名称是 ,官能团①的电子式是 ,该化合物是由 种氨基酸分子脱水形成的。写出该化合物水解生成氨基酸的结构简式(任写一种) ,并写出此氨基酸与氢氧化钠溶液反应的化学方程式 。
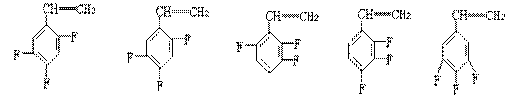
(2)上海有机化学研究所在我国氟化学理论研究和氟产品以及核化学工业等方面作出过重大贡献,如F46就是用四氟乙烯与全氟丙烯共聚得到的,若两种单体物质的量之比1:1,试写出这种高聚物的结构简式 。已知三氟苯乙烯(三年氟均连在苯环上)的分子式是C8H5F3,则它的异构体除
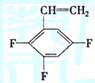

外,还有别外五种是 。
解析:解决本题的关健在于应熟练掌握各种官能团的性质。答案如下:(1)羧基; ;4;H2NCH2COO H;H2NCH2COOH+NaOH→H2NCH2COONa+H2O。
 (或另外三种氨基酸及对应的反应式)
(或另外三种氨基酸及对应的反应式)
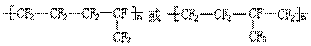
(2) ;
[随堂检学]
1.下列物质中,属于天然高分子化合物的是
A.淀粉 B.油脂 C.聚乙烯 D.蔗糖
缩聚物的单体的判断的关键是键的断的位置以及断键后应该加什么样的基团。许多小分子相互作用,生成高分子化合物,同时释出水、醇、氨、氯化氢等物质。起缩聚反应的化合物必须含有两种或两种以上的官能团,它们可以是两种相同的分子,也可以是两种不同的分子。
 两种(或两种以上)单体可以同时进行聚合,生成含有这两种(或两种以上)结构单位的大分子。
两种(或两种以上)单体可以同时进行聚合,生成含有这两种(或两种以上)结构单位的大分子。
⑴凡链节的碳链为两个碳原子的,其合成单质为一种。

 如 [CH2-CH2
]n 单体为CH=CH2
如 [CH2-CH2
]n 单体为CH=CH2
⑵凡链节中无碳碳双键,故链节中必为每2个碳原子分为一组,作为一个单体。


 如: [CH2-CH2-CH-CH2]n 单体为CH2=CH2和CH3CH=CH2
如: [CH2-CH2-CH-CH2]n 单体为CH2=CH2和CH3CH=CH2
 CH3
CH3
*⑶凡链节中存在碳碳双键结构,且
①主链为四个碳原子的,其合成单体必为一种,将链节的单键和双键互换即得高聚物的单体。



 如: [CH2-C=CH-CH2 ]n单体为:CH2=C-CH=CH2
如: [CH2-C=CH-CH2 ]n单体为:CH2=C-CH=CH2
CH3 CH3
②主链节为六个碳原子的,其合成单体为两种。其中含双键的主链上的四个碳原子为一单体,另二个碳原子为一单体。
2. 有机高分子单体的推断:
高聚物的单体的确定方法比较灵活,既要充分考虑原料、高聚物的结构特点,也要实事求是,适当进行变通迁移。由于单体经过某些化学反应(如加聚、缩聚、开环等)生成高聚物,所以在高分子链中,单体转变为在化学组成上能够重复的最小单位,即链节。判断高聚物的单体,就是根据高分子链,结合单体间可能发生的反应机理,找出高分子链中的链节,然后将其完形便得其单体。结合中学课本,归纳出以下几条判断规津:
1. 聚合反应类型:
(1)加成聚合(聚合)反应:不饱和的单体聚合成高分子的反应。如:
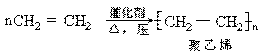
(2)缩合聚合(缩聚)反应:单体间相互反应而生成高分子,同时还生成小分子(如水、氨、氯化氢等)的反应(又叫逐步聚合反应)。

简单介绍常见的几种合成材料中的有机高分子化合物的聚合反应,了解单体、链节、聚合度、加聚反应、缩聚反应,了解高分子合成研究的一些课题。
2、认识并建立氧化剂、还原剂的概念,能根据元素的化合价预测物质的性质。
[典例解析]
例1.下列反应既是氧化还原反应又是化合反应的是 ( )
A. C+O2==CO2
B. 3CO + Fe2O3 ==2Fe + 3CO2
C. 2KClO3 ==2KCl + 3O2
D. NaOH + HCl==NaCl +H2O
[解析]分别从化合反应和氧化还原反应概念入手可知。
[答案] A
例2.在氧化还原反应中,下列叙述正确的是 ( )
A物质失电子的反应为氧化反应。
B物质在变化中失去了电子,此物质被还原。
C发生电子转移的反应是氧化还原反应。
D发生化合价升降的反应不一定是氧化还原反应。
[解析]物质失去电子的反应,叫氧化反应;该物质被氧化。有电子转移或化合价升降的反应为氧化还原反应。
[答案]AC
例3、根据下列反应
①2H2S+SO2====3S↓+2H2O
②2FeCl2+Cl2====2FeCl3
③2FeCl3+2HI====2FeCl2+2HCl+I2
④I2+SO2+H2O====H2SO4+2HI
判断氧化性物质的氧化性由强到弱的顺序是( )
A.Cl2>I2>FeCl3>SO2>S
B.Cl2>FeCl3>I2>SO2>S
C.Cl2>FeCl3>SO2>I2>S
D.FeCl3>Cl2>I2>SO2>S
E.Cl2>I2>SO2>S>FeCl3
[解析]据氧化还原反应的性质传递规律,分析每一反应:反应①中氧化剂是SO2,氧化产物是S,则氧化性:SO2>S,同理反应②中Cl2>FeCl3,反应③中FeCl3>I2,反应④中I2>SO2,联系四个结论,可得氧化性顺序:Cl2>FeCl3>I2>SO2>S。所以,正确答案为B。
例4、在反应3BrF3 + 5 H2O == HBrO3 + 9HF + Br2 + O2中,若有5molH2O参加反应,则被水还原的BrF3的物质的量为 ( )
A.3mol B.10/3mol C.4/3mol D.2mol
[解析]反应中BrF3既作了氧化剂,其还原产物为Br2,又作了还原剂,其氧化产物为HBrO3;参加反应的H2O又一部分为还原剂,另一部分为反应物,并未参与氧化还原反应,二者的比例为2︰3,即5molH2O参加反应时有2mol为还原剂,利用得失电子数相等,被还原的BrF3的物质的量为4/3mol
[答案]C
1、认识并建立氧化还原反应的概念,理解氧化还原反应的本质是电子转移。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com