
题目列表(包括答案和解析)
电子得失守恒是指在发生氧化-还原反应时,氧化剂得到的电子数一定等于还原剂失去的电子数,无论是自发进行的氧化-还原反应还是原电池或电解池中均如此
[例题]将纯铁丝5.21克溶于过量稀盐酸中,在加热条件下,用2.53克KNO3去氧化溶液中亚铁离子,待反应后剩余的Fe2+离子尚需12毫升0.3摩/升KMnO4溶液才能完全氧化,写出硝酸钾和氯化亚铁完全反应的方程式
[分析]铁跟盐酸完全反应生成Fe2+,根据题意可知Fe2+分别跟KMnO4溶液和KNO3溶液发生氧化还原反应,KMnO4被还原为Mn2+,那么KNO3被还原的产物是什么呢?
根据电子得失守恒进行计算可得KNO3被还原的产物是NO,
所以硝酸钾和氯化亚铁完全反应的化学方程式为:

电荷守恒即对任一电中性的体系,如化合物、混和物、溶液等,电荷的代数和为零,即正电荷总数和负电荷总数相等
[例题]在Na2SO4和K2SO4的混和溶液中,如果[Na+]=0.2摩/升,[SO42-]=x摩/升 ,[K+]=y摩/升,则x和y的关系是
(A)x=0.5y (B)x=0.1+0.5y (C)y=2(x-0.1) (D)y=2x-0.1
[分析]可假设溶液体积为1升,那么Na+物质的量为0.2摩,SO42-物质的量为x摩,K+物质的量为y摩,根据电荷守恒可得[Na+]+[K+]=2[SO42-],所以答案为BC
元素守恒即反应前后各元素种类不变,各元素原子个数不变,其物质的量、质量也不变。
[例题]有一在空气中放置了一段时间的KOH固体,经分析测知其含水2.8%、含K2CO337.3% 取1克该样品投入25毫升2摩/升的盐酸中后,多余的盐酸用1.0摩/升KOH溶液30.8毫升恰好完全中和,蒸发中和后的溶液可得到固体
3.(A)1克 (B)725克 (C)0.797克 (D)2.836克
[分析]KOH、K2CO3跟盐酸反应的主要产物都是KCl,最后得到的固体物质是KCl,
根据元素守恒,盐酸中含氯的量和氯化钾中含氯的量相等:
n(KCl)=n(Cl-)=n(HCl)
所以答案为B
质量守恒就是化学反应前后各物质的质量总和不变,在配制或稀释溶液的过程中,溶质的质量不变。
[例题]1500C时,碳酸铵完全分解产生气态混合物,其密度是相同条件下氢气密度的
(A)96倍 (B)48倍 (C)12倍 (D)32倍
[分析]根据质量守恒定律可知混和气体的质量等于碳酸铵的质量,从而可确定混和气体的平均分子量,混和气体密度与相同条件下氢气密度的比,所以答案为C w.w.w.k.s.5.u.c.o.
w.w.w.k.s.5.u.c.o.
9.阿波罗宇宙飞船使用的是氢氧燃料电池,其电极反应为:

 2H2+4 OH-
4 H2O+4e-,O2+2 H2O+4e- 4 OH-。
2H2+4 OH-
4 H2O+4e-,O2+2 H2O+4e- 4 OH-。
在负极上发生反应的物质是
负极发生的是
(填氧化或还原)反应,电池反应是 
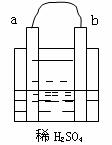
8.在右图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( )
A.碳棒上有气体放出,溶液的pH增大
B.a是正极,b是负极
C.导线中有电子流动,电子从a极流到b极
D.a极上发生了氧化反应
7.据报道,锌电池可能取代目前广泛应用的铅蓄电池,因为锌电池容量更大,而且没有铅污染。其电池反应为:2Zn+O2=2ZnO,原料为锌粒.电解质和空气,则下列叙述正确的是( )
 A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-=Zn2+
A.锌为正极,空气进入负极反应
B.负极反应为Zn-2e-=Zn2+
C.正极发生氧化反应 D.电解液肯定不是强酸
6.现在各类碱性电池已经占有了越来越多的市场份额,这类电池广泛地应用于各种小型
用电器(如照相机.收音机等)中。有一种新型的锌锰电池就是这种碱性电池,它是在传
统锌锰电池的基础上改进的。下列对于碱性锌锰电池的叙述中正确的是( )
A.由于碱性物质的存在,这种电池的缺点是容易漏液失效
B.这种电池较传统锌锰电池使用寿命长
C.这种电池的电解质由传统的KOH改进为NH4Cl
 D.这种电池的电解质由传统的NH4Cl 改进为KOH
D.这种电池的电解质由传统的NH4Cl 改进为KOH
5.日常所用干电池其电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入
MnO2氧化吸收H2),电极反应可简化为:Zn-2e=Zn2+;2NH4++2e=2 NH3+H2(NH3
再用于结合Zn2+。)根据上述叙述判断下列说法中正确的是( )
A.干电池中Zn为正极,碳为负极
B.干电池工作时,电子由Zn极经外电路流向碳极
C.干电池长时间连续使用时内装糊状物可能流出腐蚀电器
3.已知空气-锌电池的电极反应为: 锌片:Zn+2OH--2e-=ZnO+H2O
石墨:O2+2H2O+4e-=4OH- 根据此判断,锌片是( )。
A.负极,并被氧化 B.负极,并被还原 C.正极,并被氧化 D.正极,并被还原
|
 2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
2Ag+Zn(OH)2 Ag2O+Zn+H2O,在此电池放电时,负极上发生反应的物质是( )
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com