
题目列表(包括答案和解析)
1.定义:_______________________________________________________。
大气中_______含量增多是引起温室效应的最主要原因。
新课预习:
 质
_______________________
质
_______________________
家 化合物 _______________________
族 _______________________
_______________________
4.解析:证明物质中含有CO32-的方法是:该物质与盐酸反应能产生无色气泡,且该气体能是澄清的石灰水变浑浊,出现上述两点现象即可证明物质中含有CO32-。鸡蛋壳的主要成分是CaCO3,本题是验证鸡蛋壳中含有的CO32-。鸡蛋壳不溶于水,但它能与盐酸反应而溶于盐酸中,同时产生二氧化碳气体,该气体通过导管进入II中,使石灰水变浑浊。变浑浊的原因是因有难溶于水的CaCO3生成的缘故,继续通入CO2后,CO2与CaCO3、H2O反应能生成Ca(HCO3)2,使石灰水变澄清。鸡蛋壳与盐酸反应产生的气泡附在鸡蛋壳上使蛋壳受到的浮力增大,导致鸡蛋壳浮在液面上。CO2还能与水反应生成碳酸,酸能使紫色的石蕊试液变红。
答案:(1)鸡蛋壳逐渐溶解,并有大量气泡产生;鸡蛋壳浮在液面上。(2)溶液由紫色变成红色。(3)I中鸡蛋壳逐渐溶解,并有大量气泡产生,II中出现浑浊,两种现象结合足以说明鸡蛋壳含有CO32-(或I中现象和II中现象)(4)III。
5 解析:二氧化碳微溶于水,溶于水后会与碳酸钙反应,导致碳酸钙溶解。增大压强、降低温度会使气体的溶解度增大。
植物的呼吸作用放出CO2,植物蒸腾作用与外界温度及水分有关,与CO2的浓度无关;植物的光合作用需要吸收CO2,且CO2溶于土壤的水生成的碳酸电离的H+可以改良碱性土壤、调节pH,促进植物对Ca2+、Mg2+的吸收.所以“汽水”浇灌植物能促进植物的生长。
随着社会的进步,对能源的消耗也将进一步增多,所以不可能立即减少煤和石油的燃烧,使用天然气等燃料也会产生CO2,只有绿色植物的光合作用会吸收大量的CO2,且见效快。
答案:(1)CaCO3+CO2+H2O=Ca(HCO3)2
(2)大量燃烧煤、石油等矿物燃料
(3)D (4)B (5)C
3. 解析:混合物加热最终得到的是Na2CO3,根据Na+守恒,
n (Na2CO3)=1/2 n(Na+)=1/2×0.1L×0.6mol/L=0.03mol
所以,m(Na2CO3)=0.03mol×106g/mol=3.18g 答案:A
2. 解析:(设“1”法/条件变换法)将题意稍作变换,改为:等质量的下列五种物质[NH4HCO3、CaCO3、NaHCO3、Na2CO3、Ca(HCO3)2]分别与足量盐酸反应,放出气体最多的是______。用设“1”法,求放出1molCO2时所需5种物质的质量分别是多少。根据C原子守恒得:
NH4HCO3-CO2↑ CaCO3-CO2↑ NaHCO3-CO2↑ Na2CO3-CO2↑ 1/2Ca(HCO3)2-CO2↑
79 100 84 106 81
显然,含Ca(HCO3)2时放出CO2最多。 答案:D
1.解析: CO2中通常混有HCl、H2O(g),而室温1体积水溶解1体积CO2,A错;气体最后通过盛有水溶液的装置时得到的CO2是潮湿的,C、D错;气体先通过饱和NaHCO3溶液,HCl被吸收且放出CO2,再通过H2SO4得以干燥,B对。
12.解析:(1)根据NaHCO3受热分解生成Na2CO3、H2O(气)、CO2 ,将混合物加热至不再产生气体为止,可除去该混合物中的碳酸氢钠。
(2)题中介绍“加热至固体质量不再变化”,就指明其中NaHCO3已完全分解,而固体减少的质量是放出CO2和H2O(气)的质量之和。设原混合物中含NaHCO3质量为x,由题意知,
 2 NaHCO3 Na2CO3+H2O+CO2↑
2 NaHCO3 Na2CO3+H2O+CO2↑
2×84g (18+44) g
x (10.00g-9.380g)
168g:62g=x: (10.00g-9.380g)
解得 x=1.68g
ω(Na2CO3)=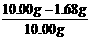 ×100%=8.320%
×100%=8.320%
答案:(1)将混合物加热至不再产生气体为止 (2)8.320%。
B卷
1 B 2 D 3 A
11.解析:由①可知碱石灰吸收的是CO2或H2O或两者的混合物;由②可知,CuO被还原为Cu,还原剂为CO或H2或二者的混合物;由③可知,反应②生成了H2O,故原混合气体中一定有氢气;由反应④可知,反应②又生成了CO2,故原混合气体中一定有CO。
答案:混合气体中一定含有CO、H2,至少含有H2O、CO2中的一种。
10.解析:本题考查学生对自然界和日常生活中有关物质的常识性了解。碳酸钙在自然界分布很广.石灰石、大理石等矿物主要成分是碳酸钙。碳酸钙遇到溶有CO2的水时,就会变成可溶性的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2 溶有碳酸氢钙的水在一定条件下重新变成碳酸钙沉淀下来,同时放出CO2。Ca(HCO3)2 CaCO3↓+H2O+CO2↑
CaCO3↓+H2O+CO2↑
在自然界里不断发生着上述反应,形成了石灰岩溶洞里的钟乳石、石笋等。自然界中含有较多碳酸氢钙等的硬水,在煮沸时会形成水壶和锅炉中的锅垢。贝壳、蛋壳也都含有碳酸钙.初中化学教材有一个关于蛋壳的家庭小实验(蛋壳+盐酸)。碳酸钙与酸反应生成CO2:
CaCO3+2H+=Ca2++H2O+CO2↑ 这是检验碳酸根的简便方法。(通常用盐酸)
所以题目给出的五种物质分别滴加醋酸时都会产生CO2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com