
题目列表(包括答案和解析)
3. 与酸的反应 与非氧化性酸的反应
与氧化性酸的反应
Fe 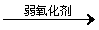

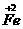 的化合物 举例:
的化合物 举例:
Fe 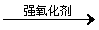

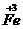 的化合物 举例:
的化合物 举例:
Fe + O2 点燃======
2. 与水的反应 Fe + H2O(g) 高温======
铁是 色金属,可以被磁铁吸引。而铜是 色金属 。铁和铜都有良好的 性和 性。铁和铜的密度 ,熔沸点 。
3. 金属冶炼的一般方法:①热分解法 ②热还原法 ③ 电解法
指出下列金属的冶炼方法:
K Ca Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
2. 铜的冶炼方法:⑴ ⑵
⑶ 湿法炼铜的原理:
1. 铁的冶炼 原料: 、 、 、 等。
设备: 。反应原理: 。
主要反应:⑴还原剂的形成 、
⑵还原铁矿石
⑶炉渣的形成 、
生铁: 钢:
 自然界中铁和铜的存在形式: 。常见的铁矿:磁铁矿
,赤铁矿 ,黄铁矿 。常见的铜矿:黄铜矿
,孔雀石
。
自然界中铁和铜的存在形式: 。常见的铁矿:磁铁矿
,赤铁矿 ,黄铁矿 。常见的铜矿:黄铜矿
,孔雀石
。
3. 10 ℃时,某物质不饱和溶液a g中含有m g溶质,若该溶液蒸发b g水并恢复到10℃时,析出溶质m1 g;若原溶液蒸发c g水并恢复到10 ℃,析出溶质m2 g,则该物质在10 ℃的溶解度的表达式为
2. 20 ℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10 g水析出1
g硝酸钾晶体,另一份恒温蒸发掉15 g水,析出2 g硝酸钾晶体。下列说法错误的是( )。
20 ℃时,把一定质量的硝酸钾溶液分成两等份,一份恒温蒸发掉10 g水析出1
g硝酸钾晶体,另一份恒温蒸发掉15 g水,析出2 g硝酸钾晶体。下列说法错误的是( )。
A.20 ℃时,若将原溶液恒温蒸发掉25 g水,可析出3 g硝酸钾晶体
B.20 ℃时,若原溶液中再加入2 g硝酸钾晶体便成为饱和溶液
C.20 ℃时,硝酸钾的溶解度为20 g
D.20 ℃时,原硝酸钾溶液的质量分数为12%
1. 室温下140 g某溶液,第一次蒸发10 g水时,溶液中析出2 g溶质,再继续蒸发20 g水时,溶液中又析出5g溶质。则原溶液至少需蒸发多少克水可变为饱和溶液( )。
A.2 g B.8 g C.10 g D.20 g
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com