
题目列表(包括答案和解析)
7. 下列变化不需要破坏化学键的是( )
A. 加热分解氯化铵 B. 干冰气化
C. 水通电分解 D. 氯化氢溶于水
6. 在核电荷数为1-18的元素中,符合最外层电子数是电子层数2倍的元素有( )
A. 1种 B. 2种 C. 3种 D. 4种
5. 下列结构示意图中,表示阴离子的是( )
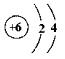
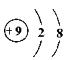
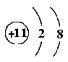
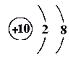
A B C D
4. 某元素的相对原子质量为59,在某氧化物中该元素的质量分数为71%,则它在该氧化物中的化合价是 ( )
A. +1 B. +2 C. +3 D. +4
3. X元素原子的核外内层电子总数是最外层电子总数的2倍,Y元素原子的核外最外层电子数是内层电子总数的3倍。则X、Y可能组成的阴离子是( )
A. XY3- B. XY4- C. XY32- D. XY43-
2. 微粒 的质量数为137,中子数为81,则核外电子数为( )
的质量数为137,中子数为81,则核外电子数为( )
A. 56 B. 54 C. 58 D. 137
1. 一种微粒的和另一种微粒的质子数相等、电子数相等,对于这两种微粒的关系,某班同学有下列四种说法,你认为错误的是( )
A. 可能是不同的分子 B 可能是不同的离子
C. 可能是同位素 D. 可能是一种分子和一种离子
(六)化学键与化学反应中的能量变化
思考:H2变为H是吸收能量还是放出能量?为什么? H变为H2是吸收能量还是放出能量?为什么?
(解答:氢原子不稳定,能量较高,氢分子稳定能量较低,故H2变为H要吸收能量;H变为H2要放出能量。)
1. 化学键与能量变化
在化学反应过程中,破坏旧化学键时,需要吸收一定的能量来克服原子(或离子)间的相互作用;形成新化学键时又要释放一定的能量。因此在化学反应中,不仅有新物质生成,而且伴随着能量变化。
思考:化学反应在什么情况下放出能量?什么情况下吸收能量?能量的类型有哪几种?
(解答:新化学键形成时所释放的能量大于破坏旧化学键所吸收的能量,结果就放出能量;反之,就吸收能量。)
2. 放热反应与吸热反应
放热反应: 反应放出热量的称为放热反应。
吸热反应: 反应吸收热量的称为吸热反应。
常见放热反应:燃烧反应是放热反应;活泼金属跟水或酸的反应是放热反应;
一般的化合反应是放热反应(C与CO2 反应等除外)。
常见吸热反应:铵盐与碱的反应;一般的分解反应。
3. 多角度认识化学反应过程
(1)从原子与分子角度:化学反应是分子分解成原子,原子重新组合成分子的过程。
(2)从化学键的角度:化学反应是旧键的断裂和新键的形成。
(3)从能量变化的角度:化学反应总是伴随着能量的变化。
4. 认识物质变化的过程:
(1)化学反应中的物质变化和能量变化。
(2)化学键与化学反应中的物质变化和能量变化的密切关系。
[典型例题]
例1. 下列说法正确的是( )
 A. 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
A. 非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
B. 非金属元素呈现的最低化合价,其绝对值等于该元素原子的最外层电子数
C. 最外层有2个电子的原子都是金属原子
D. 最外层有5个电子的原子都是非金属原子
答案:A
解析:非金属元素的最高正价等于它的最外层电子数,故A正确。B中非金属的最低化合价的绝对值等于它形成8电子稳定结构所需的电子数,也就是8减去最外层电子数。He原子的最外层有2个电子,但不是金属,C错误。最外层有5个电子的Sb、Bi,它们都是金属,D错误。
点评:原子结构决定元素原子的性质,平时应该熟练掌握原子结构的规律、特点。
例2. X、Y、Z、R分别代表四种元素,如果aXm+、bYn+、cZn-、dRm-四种离子的电子层结构相同,(a、b、c、d为元素的原子序数),下列关系正确的是( )
A. a-c=m-n B. a-b=n-m C. c-d=m+n D. b-d=n+m
答案:D
解析:据题意知X、Y、Z、R四种元素核内质子数分别是a、b、c、d。核外电子数分别为:aXm+=a-m、bYn+=b-m、cZn-=c+n、dRm-=d+m,四种离子的电子层结构相同,即四种离子的核外电子数相等:a-m=b-n=c+n=d+m。
点评:本题关键是弄清楚“离子的电子层结构相同”的含义。
例3. 下列指定微粒的个数比等于2:1的是( )
A. 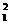 H原子的中子数和质子数
H原子的中子数和质子数
B. 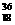 Ar原子中的质量数和中子数
Ar原子中的质量数和中子数
C.  Be2+离子中的质子数和电子数
Be2+离子中的质子数和电子数
D.  Mg2+离子中的中子数和电子数
Mg2+离子中的中子数和电子数
答案:BC
解析: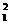 H原子的中子数为1,质子数为1;
H原子的中子数为1,质子数为1;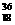 Ar原子中的质量数为36,中子数为18;
Ar原子中的质量数为36,中子数为18; Be2+离子中的质子数为4,电子数为2;
Be2+离子中的质子数为4,电子数为2; Mg2+离子中的中子数为14,电子数为10。
Mg2+离子中的中子数为14,电子数为10。
点评:本题是考查原子组成的表示方法及离子概念、质量数概念。
例4. 下列化合物分子内只有共价键的是( )
A. BaCl2 B. NaOH C. (NH4)2SO4 D. H2SO4
答案:D
 解析:Ba是活泼金属,与活泼非金属反应生成的BaCl2是离子化合物,钡、氯间的化学键是离子键。NaOH中,Na+与OH-间以离子键结合,OH-中O原子与H原子以共价键结合。(NH4)2SO4中。NH4+与SO42-间以离子键结合,NH4+中N与H,SO42-中S与O以共价键结合。H2SO4中,H和O之间S和O之间都以共共价键结合。
解析:Ba是活泼金属,与活泼非金属反应生成的BaCl2是离子化合物,钡、氯间的化学键是离子键。NaOH中,Na+与OH-间以离子键结合,OH-中O原子与H原子以共价键结合。(NH4)2SO4中。NH4+与SO42-间以离子键结合,NH4+中N与H,SO42-中S与O以共价键结合。H2SO4中,H和O之间S和O之间都以共共价键结合。
点评:酸不论强酸种类,都是共价化合物,共价化合物中没有离子,也没有离子键。
[模拟试题]
(五)化学键与化学反应中的物质变化
1. 化学键与物质变化
思考:水变成水蒸气需要什么条件?水变成氧气、氢气需要什么条件?说明了什么问题?
(解答:水变成水蒸气需要加热即可;水变成氧气、氢气需要电解;这说明水分子中的氢原子和氧原子之间存在强烈的化学作用。)
(1)化学键:相邻的原子间强的相互作用叫化学键。
(2)化学反应中物质变化的实质:旧化学键的断裂和新化学键的形成。
2. 化学键的类型
分析:HCl、H2、Cl2的形成过程
(1)共价键:
定义:原子间通过共用电子对形成的化学键,叫做共价键。
共价键形成条件:一般是非金属原子之间形成。
共价键的存在:共价化合物、非金属单质、某些原子团中
共价键的类型:
极性共价键:不同的非金属原子之间或非金属与金属原子之间。
非极性共价键:相同的非金属原子之间形成的共价键。
共价键的表示方法:
①电子式法
用电子式表示共价型分子:HCl、N2、NH3、H2O等。
用电子式表示共价型分子的形成过程:CH4、Cl2、CO2等。
②结构式法:用一根短线代替一个共用电子对。
练习分析:NaCl、Na2S、CaCl2的形成过程
(2)离子键:
定义:阴、阳离子之间通过静电作用形成的化学键,叫做离子键。
离子键形成条件: 活泼金属与活泼非金属及其他的阴、阳离子之间。
离子键的存在:离子化合物
离子键的表示方法--电子式法
用电子式表示某物质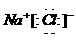 、
、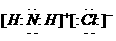 等。
等。
用电子式表示某物质的形成过程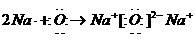
3. 化学键与物质构成:
离子化合物:含有离子键的化合物叫做离子化合物。
共价化合物:只含有共价键的化合物叫做共价化合物。
 思考:离子化合物熔、沸点较高的原因是什么?金刚石熔、沸点较高的原因是什么?干冰气化破坏的是碳氧化学键吗?
思考:离子化合物熔、沸点较高的原因是什么?金刚石熔、沸点较高的原因是什么?干冰气化破坏的是碳氧化学键吗?
(解答:离子化合物熔沸点较高的原因是熔化、气化时需要破坏较强的离子键的作用;金刚石熔沸点较高的原因是熔化时要破坏较强的共价键的作用;干冰气化时破坏的不是碳氧键。)
拓宽:分析Na2O2、NaOH、Ca(OH)2、NH4Cl中的化学键和电子式
(四)核外电子的运动规律
在多电子的原子中,核外电子是分层运动的,也叫分层排布。
1. 核外电子的排布规律:
(1)核外电子是分层排布的。
(2)电子总是由内向外排布,先排布离核最近的电子层,然后依次往外。
(3)每个电子层最多容纳_____________个电子。
(4)最外层最多容纳_____________个电子,次外层最多容纳_____________个电子,倒数第三层最多容纳_____________个电子。
2. 核外电子排布的表示方法:
用原子结构示意图表示
练习:分别画出Na、N、S、C元素的原子结构示意图
 提示:为了便于理解,人们形象地用“电子云”、“轨道”来描述核外电子的运动。
提示:为了便于理解,人们形象地用“电子云”、“轨道”来描述核外电子的运动。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com