
题目列表(包括答案和解析)
3. 核同,价高半径小。即对同一种元素形成的不同的简单微粒中,化合价高的微粒的半径小。如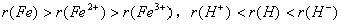 。
。
2. 层异,层大半径大。即当微粒的电子层数不同时,结构相似的微粒中,电子层数大的微粒半径大。如:
层异,层大半径大。即当微粒的电子层数不同时,结构相似的微粒中,电子层数大的微粒半径大。如: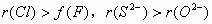 。。
。。
1. 层数相同,核大半径小。即电子层数相同时,结构相似的微粒中核电荷数大的微粒半径小。例如: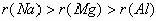 。
。
3.元素周期表及元素周期律应用
◎农药多数是含__元素的化合物,在周期表的____。
◎半导体材料都是____的元素,如硅、锗等。
◎催化剂的选择:人们在长期的生产实践中发现___元素对许多化学反应有良好的催化性能。这些元素的催化性能跟它们的原子的次外层电子层电子排布的特点有密切关系。
疑难点拨
2、元素化合价与元素在周期表中位置的关系:
对于主族元素:最高正价= 族序数;最高正化合价 +∣最低负价∣= 8。
1.元素的金属性和非金属性与元素在周期表中的递变关系
(1)同周期元素:同周期,电子层数相同,即原子序数越大,原子半径越 ,核对电子的引力越 ,原子失电子能力越 ,得电子能力越 ,金属性越 、非金属性越 。
(2)同主族元素:同主族,电子层数越多原子半径越 核对电子引力越 原子失电子能力越强得电子能力越弱金属性越 、非金属性越 。
2、硅、磷、硫、氯的非金属性的递变规律
|
|
Si |
P |
S |
Cl |
|
最高正价 |
 |
|
|
|
|
最低负价 |
|
|
|
|
|
单质与氢气反应的条件及氢化物稳定性 |
|
|
|
|
|
最高价氧化物 |
|
|
|
|
|
离高价氧化物的水化物 |
H4SiO4 弱酸 |
H3PO4 中强酸 |
H2SO4 强酸 |
HClO4 最强无机酸 |
 酸性逐渐增强 酸性逐渐增强 |
||||
|
结论 |
|
综上所述,我们可以从11-18号元素性质的变化中得出如下结论:
Na Mg Al Si P S Cl Ar
 金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
金属性逐渐减弱,非金属性逐渐增强 稀有气体元素
金属性的判断:①单质与水反应置换出氢的难易程度;②单质与酸反应置换出氢的难易程度③最高价氧化物对应的水化物(氢氧化物)的碱性强弱。
非金属性的判断:①与氢气反应生成氢化物的难易程度;②氢化物的稳定性;③最高价氧化物对的水化物的酸性强弱。
1、探究第三周期元素性质递变规律:
(1)钠镁铝金属性的递变规律
①与水反应:Mg常温下与水无明显现象;加热镁带表面有大量气泡出现,滴入酚酞溶液变红。Al在常温或加热下,遇水无明显现象。
②与酸反应:Mg与盐酸反应要比Al剧烈。与Mg反应的试管壁温度_,与Al反应的试管壁温度_。
③Na2O、MgO为碱性氧化物,Al2O3为两性氧化物。Al(OH)3为两性两性氢氧化物。
_Al2O3+_HCl = __+__ ; _Al2O3+_NaOH = ___+___。
_Al(OH)3+_H2SO4 == __+__; _Al(OH)3+_NaOH =__+___。
3.元素性质原子核外电子排布的关系
(1)稀有气体元素的原子最外层有8个电子(He为2)处于稳定结构,化学性质稳定,一般不跟其它物质发生化学反应。
(2)非金属性与金属性(一般规律):
|
|
电外层电子数 |
得失电子趋势 |
元素性质 |
|
金属元素 |
<4 |
__ |
___ |
|
非金属元素 |
>4 |
__ |
___ |
2.核外电子排布规律
电子由内向外按能量由低到高分层排布,第n层最多容纳的电子数为__,最外层电子数≤_。(K层为最外层不超过_个)。次外层电子数≤__,倒数第三层电子数≤__。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com