
题目列表(包括答案和解析)
5.随着原子序数的递增,元素的核外电子排布、主要化合价、金属性和非金属性都呈现周期性的变化规律,这一规律叫做元素周期律。
[练习]
4. 结论: Si P S Cl
结论: Si P S Cl
单质与H2的反应越来越容易 生成的氢化物越来越稳定
最高价氧化物对应水化物的酸性逐渐增强
故:非金属性逐渐增强。
Na Mg Al Si P S Cl
 金属性逐渐减弱,非金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
同周期从左到右,金属性逐渐减弱,非金属性逐渐增强
3.碱性 NaOH > Mg(OH)2> Al(OH)3 金属性:金属性 Na > Mg > Al
Na Mg Al
 金属性逐渐减弱
金属性逐渐减弱
2.Mg + 2HCl =MgCl2 + H2 ↑ (容易) 2Al + 6 HCl = 2AlCl3 +3H2 ↑(较难)
金属性:Mg > Al 根据1、2得出: 金属性 Na > Mg > Al
1.2Na + 2H2O =2NaOH + H2 ↑ (容易)
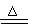 Mg + 2 H2O 2Mg(OH)2 + H2 ↑(较难) 金属性:Na
> Mg
Mg + 2 H2O 2Mg(OH)2 + H2 ↑(较难) 金属性:Na
> Mg
19.下列各组指定原子序数的元素,不能形成AB2型化合物的是( )
A.6和8 B.16和8 C.12和9 D.11和6
18. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( )
A.XY2 B.X2Y3 C.X3Y2 D.X2Y
17. 在下列元素中,最高正化合价数值最大的是( )
A.Na B.P C.Cl D.Ar
2.最高正化合价和最低负化合价:
随着原子序数的递增,每隔一定数目的元素,会重复出现原子最高价由

 +1 +7,中部出现负价,由-4 -1 的变化规律。
+1 +7,中部出现负价,由-4 -1 的变化规律。
(1)O、F无正价,金属无负价
(2)最高正化合价:+1→+7 最低负化合价:-4→-1→0
 (3)最高正化合价=最外层电子数=主族序数
(3)最高正化合价=最外层电子数=主族序数
(4)最高正化合价+∣最低负化合价∣=________
(5)最高正化合价+最低负化合价= 0 、2、 4、 6
 最外层电子数= 4 5 6 7
最外层电子数= 4 5 6 7
[练习]
1.核外电子层排布:
随着原子序数的递增,每隔一定数目的元素,会重复出现原子“最外层电子从_______个递增到_________个的情况(K层由1-2)而达到结构的变化规律。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com