
题目列表(包括答案和解析)
2.HF、H2O、CH4、SiH4四种气态氢化物按稳定性由弱到强排列正确的是 ( )
A.CH4<H2O<HF<SiH4 B.SiH4<HF<CH4<H2O
C.SiH4<CH4<H2O<HF D.H2O<CH4<HF<SiH4
1.A、B、C、D、E五种元素的原子的原子序数都小于18且具有相同的电子层,A和B的最高价氧化物对应的水化物均呈碱性,且碱性B>A,C和D的气态氢化物的稳定性C>D;E是这五种元素中原子半径最小的元素,则它们的原子序数由小到大的顺序 ( )
A.A、B、C、D、E B.E、C、D、B、A
C.B、A、D、C、E D.C、D、A、B、E
2. 元素周期律
⑴原子半径的递变规律:同周期元素的原子半经随 原子序数递减 ;
同主族元素的原子半经随 电子层数递增 。
⑵同主族元素金属性的递变规律(IA族):从上到下金属性 逐渐增强
①金属单质与水或酸置换出氢:由 易 到 难
②最高价氧化物的水化物碱性:由 强 到 弱
⑶同主族元素非金属性的递变规律(ⅦA族):从上到下非金属性 逐渐递减弱
①非金属单质与氢气反应:由 易 到 难 ; ②气态氢化物的稳定性顺序:由 强 到 弱 ;③最高价氧化物的水化物酸性:由 弱 到 强 。
⑷主族元素化合价规律
①元素最高正化合价数=主族序数=最外电子层数
②元素最低负化合价数=8-主族序数
练习二:
5.A+、B-、C、D四种微粒中均有氢原子,且电子总数均为10个。溶液中的A+和B-在加热时相互反应可转化为C和D。
用电子式表示:A 、B- 、C 、D 。
4.有X、Y两种原子,X原子的M层比Y原子的M层少3个电子,Y原子的L层电子数恰好是X原子L层电子数的二倍,则X为 ,Y为
3.核外电子排布相同的离子Am+和Bn-,两种元素的质子数,前者与后者的关系是 ( A )
A.大于 B.小于 C.等于 D.不能肯定
2.已知aXm+和bYn-的电子层结构相同,则下列关系式正确的是 ( A )
A. a=b+m+n B. a=b-m+n C. a=b+m-n D. a=b-m-n
1.某元素核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( C )
A.S B.C C.Si D.Cl
1. 原子核外电子的排布
⑴电子总是从能量 低 的电子层排起,然后由 里 向 外 排;
⑵各层最多能容纳的电子数目为 2n2 ;
⑶最外层最多能容纳的电子数目为8(K层为最外层时,不超过2个电子),次外层电子数目不超过18,倒数第三层不超过32个电子。
练习一:
15. 由钾和氧组成的物质含钾的质量分数是
由钾和氧组成的物质含钾的质量分数是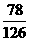 ,其阴离子只有过氧根离子(O22-)和超氧根离子(O2-)两种。求在此物质中,过氧根离子和超氧根离子的个数比
,其阴离子只有过氧根离子(O22-)和超氧根离子(O2-)两种。求在此物质中,过氧根离子和超氧根离子的个数比
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com