
题目列表(包括答案和解析)
3.电能转化为化学能:电解氯化铜溶液
⑴阴极与电源 负极 相连;阳极与电源 正极 相连;
⑵电子的流向:电子由 电源的负极流向电解池的阴极 , 电解池的阳极流向电源的正极
⑶阴、阳离子的移动方向: Cu2+由阳极流向阴极 , Cl-由阴极流向阳极阴离子
⑷电解池电极反应(惰性电极):
 阳极:2Cl--2e-=Cl2↑(反应类型:
氧化反应 )
阳极:2Cl--2e-=Cl2↑(反应类型:
氧化反应 )
阴极:Cu2++2e-=Cu (反应类型: 还原反应 )
 总反应:CuCl2 Cu+Cl2↑
总反应:CuCl2 Cu+Cl2↑
练习三
2.原电池的构成条件
①有两种活泼性 不同的电极材料 ;②电极材料均插入 电解质溶液 中;
③两极相连形成 闭合回路 ;④存在 自发的氧化还原反应
1.原电池:把 化学能 转化为 电能 的装置
①铜锌原电池的正负极:锌是 负极 、铜是 正极
②外电路电子流向: 电子由负极流向正极(即由锌流向铜)
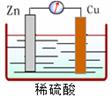 ③内电路阴阳离子流向:电解质溶液中,Zn2+和H+向
正极 移动,SO42-向
负极 移动。
③内电路阴阳离子流向:电解质溶液中,Zn2+和H+向
正极 移动,SO42-向
负极 移动。
④现象: 负极锌片 不断溶解, 正极铜片上 有气泡产生
⑤电极反应:
正极: 2H++2e-=H2 ↑ ;(反应类型: 还原反应 )
负极: Zn-2e-=Zn2+ ;(反应类型: 氧化反应 )
总的反应可表示为: Zn+2H+=Zn2++H2↑ 。
3.把煤作为燃料可通过下列两个途径:
途径Ⅰ:C(s)+O2 (g)
CO2(g)(放热Q1J),
(g)
CO2(g)(放热Q1J),
途径Ⅱ: ①先制水煤气:C(s)+H2O(g)=
CO(g)+H2(g)(吸热Q2J)
①先制水煤气:C(s)+H2O(g)=
CO(g)+H2(g)(吸热Q2J)
 ②再燃烧水煤气:CO(g)+1/2O2 (g) CO2,H2(g)+1/2O2 (g) H2O(g) (共放热Q3J)
②再燃烧水煤气:CO(g)+1/2O2 (g) CO2,H2(g)+1/2O2 (g) H2O(g) (共放热Q3J)
试回答下列问题:
⑴途径Ⅰ放出的热量 (填“大于”、“等于”或“小于”)途径Ⅱ放出的热量。
⑵Q1、Q2、Q3的数学关系式是 。
⑶由于制取水煤气反应里,反应物所具有的总能量 生成物所具有的总能量,所以反应过程中,反应物应需要 能量才能转化为生成物,因此其反应条件为 。
⑷简述煤通过途径Ⅱ作为燃料的意义是:
。
2.已知H2(g) + C12(g) = 2HCl(g);△H=-184.6kJ·mol-1,则反应HCl(g)= 1/2H2(g) +1/2 Cl2(g)的△H为 ( )
A.+92.3 kJ·mol-1 B.-92.3 kJ·mol-1 C.-369.2 kJ·mol-1 D.+184.6 kJ·mol-1
1.下列说法正确的是 ( )
A.在化学反应中发生物质变化的同时,不一定发生能量变化
B.ΔH >0表示放热反应,ΔH<0表示吸热反应
C.ΔH的大小与热化学方程式中化学计量数无关
D.生成物释放的总能量大于反应物吸收的总能量时,ΔH<0
3.热化学方程式的书写: CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol
①不需注明反应条件,但要注明反应物和生成物的 状态 ②单位一般采用 kJ/mol ;
③热化学方程式中的计量数可以取分数,但数值与 ΔH 数值要对应;
④应注明反应时的 温度和压强 ,如不注明则指25 ℃、101 kPa。
练习二:
2.常见的放热、吸热反应
⑴放热反应: 所有燃烧 、中和反应 、 金属与酸生成气体的反应 、 大多数的化合反应
 ⑵
⑵ 吸热反应:
吸热反应:
①C(s) +CO2(g) 2CO(g) ②C(s) +H2O(g) CO(g) + H2(g)
③Ba(OH)2·8H2O(s) + 2NH4Cl(s) = BaCl2(aq) +2NH3(g) + 10H2O(l) ④大多数的分解反应
1.吸热反应和放热反应
∑E(反应物)-∑E(生成物)=△H
当△H>0时, 吸热 反应;当△H<0时, 放热 反应(填“吸热”或“放热”)
5.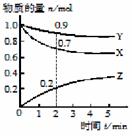 某温度时,在2
L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
某温度时,在2
L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如图所示。
①由图中数据分析,该反应的化学方程式为
;
②反应开始至2 min,Z的平均反应速率为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com