
题目列表(包括答案和解析)
3、饱和Na2CO3溶液的作用。①.乙酸乙酯在饱和Na2CO3溶液中的溶解度较小,减小溶解,利于分层。②挥发出的乙酸与Na2CO3反应,除掉乙酸;挥发出的乙醇被Na2CO3溶液吸收。避免乙酸特殊气味干扰乙酸乙酯的气味。
典例剖析
[例1] 某有机物分子式是C3H4O2,它的水溶液显酸性,既能跟碳酸钠溶液反应,能使溴水褪色。写出这种有机物的结构简式。
解析:分子中含有两个氧原子,水溶液呈酸性,能跟碳酸钠溶液反应,应属于羧酸。从分子中氢原子数看,烃基不饱和,使溴水褪色发生的是加成反应。可判断分子中含有不饱和碳碳键和羧基。答案:CH2==CHCOOH。
[例2]下列化合物中,既显酸性,又能发生酯化反应和消去反应的是

解析:根据各类官能团的性质判断:"-COOH"显酸性,"-COOH"和"-OH"能发生酯化反应,含有"-OH"或"-X"的能发生消去反应。综合判断,只有C符合题意。
[例3]将质量相等的下列各物质完全酯化时,需醋酸质量最多的是
A.甲醇 B.乙二醇 C.丙醇 D.甘油
解析:若某醇质量为1g,该醇分子量为M,该醇分子量含有x个羟基。则1g该醇含羟基(也即酯化时需羧基或醋酸)物质的量为: , 比较4种醇
, 比较4种醇 值,即可判断出正确答案。
值,即可判断出正确答案。
 ,可见,相等质量的4种醇中,甘油酯化消耗的醋酸最多。故正确答案为D。
,可见,相等质量的4种醇中,甘油酯化消耗的醋酸最多。故正确答案为D。
[例4]怎样以H2O、H218O、空气、乙烯为原料制取 ?写出有关反应的化学方程式。
?写出有关反应的化学方程式。
解析:解题时,可采用从最终的目标产物倒推原料(或中间产物)的方法。如:

答案: 有关反应的化学方程式为:

知能练习
2、装置:液-液反应装置。用烧瓶或试管。试管倾斜成45°(使试管受热面积大)。弯导管起冷凝回流作用。导气管不能伸入饱和Na2CO3溶液中(防止Na2CO3溶液倒流入反应装置中)。
1、化学原理:浓硫酸起催化脱水作用。
2、反应条件:浓H2SO4,加热 。
1、醇分子结构:与-OH相连的碳必须有相邻的碳原子,且此相邻的碳原子上还必须连有氢原子时,才能发生消去反应。
即:
如: 都不能发生消去反应。
都不能发生消去反应。
2、规律
(1)-OH连在链端点碳原子上的醇,即R-CH2OH结构的醇,被氧化成醛。
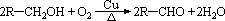
(2)与-OH相连碳原子上只有一个氢原子的醇,即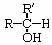 结构的醇,被氧化成酮(
结构的醇,被氧化成酮( ,其中R、R′为烃基,可同,可不同)。
,其中R、R′为烃基,可同,可不同)。
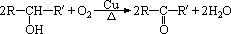
(3)与-OH相连碳原子上没有氢原子的醇,即 结构的醇(R、R′、R″为烃基,可相同可不同),不能被催化氧化。
结构的醇(R、R′、R″为烃基,可相同可不同),不能被催化氧化。
∵  不能形成
不能形成 。
。
1、发生条件:醇分子结构中与-OH相连的碳原子上至少要有一个氢原子,即具有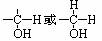 的结构。因为醇的催化氧化,其实质是“去氢”。
的结构。因为醇的催化氧化,其实质是“去氢”。

在有机反应中,氧化反应是指有机物去氢或加氧的反应,上述氧化反应也可通过碳元素的平均价态的变化来理解。

|
名称 区别 |
羟基 |
氢氧根 |
|
电子式 |

|

|
|
电性 |
不显电性 |
显负电性 |
|
稳定程度 |
不稳定 |
较稳定 |
|
存在 |
不能独立存在,与其他基相结合在一起 |
能独立存在 |
2、乙酸化学性质
(1)与CaCO3的反应化学方程式: ;
(2)乙酸的酸性比碳酸的 ;与乙醇的酯化反应化学方程式: ;酯化反应是 反应,反应进行的比较缓慢,反应物不能完全变成生成物;为防爆沸需加入 ,为了提高反应速率,一般要加入做催化剂,并加热。
(3) 酯化反应实质:有机羧酸脱___,醇脱______。
疑难点拨
1.乙醇化学性质
(1)与金属钠的反应化学方程式 ;
(2)与氧气的反应化学方程式: ;
(3)在焊接铜漆包线的线头时,常把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下再焊接,这是因为(用化学方程式表示):
① ②
(4)钠分别与水、乙醇反应的比较
|
|
钠与水的反应实验 |
钠与乙醇的反应实验 |
|
钠的现象 |
|
|
|
声的现象 |
有“啧啧”的声音 |
无任何声音 |
|
气的现象 |
观察不到气体的现象 |
有无色、无味气体生成,作爆鸣实验时有爆鸣声 |
|
实验结论 |
钠的密度小于水的密度,熔点低。钠与水剧烈反应,单位时间内放出的热量大,反应生成氢气。2Na + 2H2O == 2NaOH +H2↑水分子中氢原子相对较活波 |
钠的密度大于乙醇的密度。钠与乙醇缓慢反应生成氢气。2Na + 2C2H5OH→
2C2H5ONa
+ H2↑乙醇分子里羟基氢原子相对不活泼 |
|
反应实质 |
|
|
(5) 乙醇的分子结构与化学性质的关系

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com