
题目列表(包括答案和解析)
3.实验室用98%、密度为1.84 g / cm3的硫酸,配制成浓度为0.46 mol / L的硫酸溶液200 mL。
(1) 请按正确的操作程序和要求,给操作程序编号,将序号写在括号内:
( )用量筒量取浓硫酸;( )洗净所用的仪器;( )振荡摇匀;
( )稀释浓硫酸;( )用胶头滴管加水至刻度;( )将稀释后的硫酸转入容量瓶
(2) 写出下列操作的要求
a. 稀释浓硫酸的操作:____________________________
b. 用量筒量取浓硫酸的操作中应注意:
① ____________________________________________________________________,
② ____________________________________________________________________。
2. (1) 250 (2) 20.8; C (3) ③①④② (4) 偏低;偏低 (5) 干燥洁净
2.用质量分数为37.5%的浓盐酸(密度为1.16 g / cm3)配制成1 mol / L的稀盐酸。现实验室仅需要这种盐酸220 mL。试回答下列问题:
(1) 配制稀盐酸时,应选用容量为 mL的容量瓶;
(2) 经计算需要 mL浓盐酸,在量取时宜选用下列量筒中的 。
A. 5 mL B. 10 mL C. 25 mL D. 50 mL
(3) 在量取浓盐酸后,进行了下列操作:
① 等稀释的盐酸其温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
② 往容量瓶中小心加蒸馏水至液面接近环形标线2-3 cm处,改用胶头滴管加蒸馏水,使溶液的凹面底部与瓶颈的环形标线相切。
③ 在盛盐酸的烧杯中注入蒸馏水几十毫升,并用玻璃棒搅动,使其混合均匀。
④ 用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号) 。
(4) 在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度是
(填“偏高”、“偏低”、“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是 (填“偏高”、“偏低”、“无影响”)。
 (5)
配制完后,应将容量瓶中的稀盐酸转移到
的试剂瓶中存放,盖好塞子并贴上标签。
(5)
配制完后,应将容量瓶中的稀盐酸转移到
的试剂瓶中存放,盖好塞子并贴上标签。
1. 4
1.把一定量的溶质质量分数为10%的氢氧化钠溶液蒸发掉8 g水以后,还剩下溶液25 mL,溶质质量分数变为12.5%。这种浓缩后的溶液的物质的量浓度是 mol / L。
12. 分子量为M的某物质在室温下的溶解度为S g/100g水, 此时测得饱和溶液的密度为d g / cm3。则该饱和溶液的物质的量浓度是 ( B )
A. 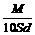 mol / L B.
mol / L B. 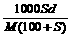 mol / L
mol / L
C. 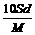 mol / L D.
mol / L D. 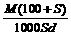 mol / L
mol / L
11.有三种不同浓度的稀硫酸,体积比依次为3∶2∶1,它们分别与等物质的量的K2CO3、KHCO3、Al刚好完全反应,此三种硫酸的物质的量浓度比为 ( C )
A. 1∶1∶1 B. 6∶2∶3 C. 4∶3∶18 D. 2∶1∶3
10.在H2SO4和Al2(SO4)3的混合溶液中,铝离子浓度是0.4 mol / L,硫酸根离子浓度是0.7 mol / L,则氢离子浓度最接近于 ( B )
A. 0.1 mol / L B. 0.2 mol / L C. 0.3 mol / L D. 0.4 mol / L
9.在无土栽培中,配制1 L内含0.50 mol NH4Cl、0.16 mol KCl、0.24 mol K2SO4的某营养液。若用KCl、NH4Cl、(NH4)2SO4三种固体配制,则需此三种固体的物质的量(mol)分别为
( D )
A. 0.40、0.50、0.12 B. 0.66、0.50、0.24
 C. 0.64、0.50、0.24 D.
0.64、0.02、0.24
C. 0.64、0.50、0.24 D.
0.64、0.02、0.24
8.将等体积的氯化铝溶液和氢氧化钾溶液混合,所得沉淀物中含铝元素的物质的量与反应之后混合溶液中含铝元素的物质的量相等。则原氯化铝、氢氧化钾两种溶液的物质的量浓度之比可能是 ( BD )
A. 1∶3 B. 2∶3 C. 1∶4 D. 2∶7
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com