
题目列表(包括答案和解析)
9. 19.1 mol / L;5.24 mL
9.50% NaOH溶液的密度为1.525 g / cm3,计算该溶液中溶质的物质的量浓度。要配制0.1 mol / L的稀NaOH溶液100 mL,,需要50% NaOH溶液多少mL?
8. 24%;2.7 mol / L
8.在20℃时,3.16 g硝酸钾溶于10 g水可得到饱和溶液,该饱和溶液的密度为1.13 g / cm3,计算该饱和溶液中溶质的质量分数和物质的量浓度。
7. 30.88%;3.86 mol / L
7.将100 mL 98%(密度为1.84 g / cm3)浓硫酸与400 mL蒸馏水混合制成稀硫酸,如测得稀硫酸的密度为1.225 g / cm3。求所得稀硫酸中溶质的质量分数和物质的量浓度。
提示:注意溶液体积的变化。
6. (1) w =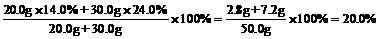
(2) 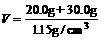 = 43.48 cm3;
= 43.48 cm3;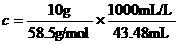 = 3.93 mol / L
= 3.93 mol / L
 (3) 设1000 g水中需溶解NaCl的物质的量为x,则
(3) 设1000 g水中需溶解NaCl的物质的量为x,则 ,x = 4.27 mol。
,x = 4.27 mol。
6.常温下,将20.0 g 14.0%的NaCl溶液,跟30.0 g 24.0%的NaCl溶液混合,得到密度为1.15 g / cm3的混合溶液。计算:
(1) 该混合溶液中溶质的质量分数;
(2) 该溶液中溶质的物质的量浓度;
(3) 在1000 g水中需溶入多少mol NaCl,才能使其浓度恰好与上述混合溶液的浓度相等。
5. 138 mL
5.在100 mL 36.5%的浓HCl(密度为1.18 g / cm3)中加入多少mL2mo l / L的稀HCl(密度为1.08 g / cm3),才能配成6 mol / L盐酸(密度为1.10 g / cm3)?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com