
题目列表(包括答案和解析)
3.物质的量浓度与质量分数的关系
C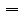
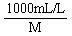 ρω
ρω
其中,C表示溶液的物质的量浓度,单位是mol/L。ρ表示溶液的密度,单位是g/cm3。ω表示溶液的质量分数。M表示溶质的摩尔质量,单位是g/mol。
特别提示:
(1).物质的量浓度和溶液中溶质的质量分数的比较:
|
内容 |
物质的量浓度 |
溶质的质量分数 |
|
定义 |
以单位体积溶液所含溶质的物质的量来表示溶液组成的物理量 |
用溶质的质量与溶液的质量之比表示溶液组成的分数 |
|
溶质的单位 |
mol |
g |
|
溶液的单位 |
L |
g |
|
计算公式 |
物质的量浓度C 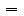 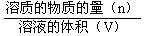 |
溶质的质量分数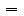  ×100% ×100% |
|
特点 |
①体积相同,物质的量浓度也相同的任何溶液中,所含溶质的物质的量相同,但溶质的质量不一定相同 |
①质量相同,溶质的质量分数也相同任何溶液中,所含溶质的质量相同,但溶质的物质的量不一顶相同 |
|
②将一份溶液分割为若干份,各份体积中所含溶液的溶质的物质的量可能不同,但它们的浓度不变,是相同的。 ③将溶液进行稀释或浓缩后,溶液的体积和浓度变了,但溶质的质量、物质的量不变。 |
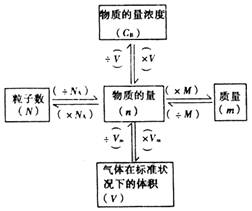
(2).以物质的量为中心的网络关系图:
[质疑激趣]:
一定质量分数的溶液配制是将已称取好的溶质加入到盛有一定质量的水的烧杯中,用玻璃棒搅拌均匀即可。而一定物质的量浓度的溶液是怎样配制的?
2.物质的量浓度的计算公式:
由物质的量浓度的概念可推知物质的量浓度的计算公式为: .
[误区警示]:
(1)公式中V为溶液的体积,并不等于溶剂的体积,是溶质和溶剂混合溶解后的体积。
 (2).溶质是指溶解在溶液中的物质,可以是单质、化合物,也可以是离子。
(2).溶质是指溶解在溶液中的物质,可以是单质、化合物,也可以是离子。
(3).利用公式计算溶质的物质的量浓度时,关键是从已知条件中找出溶质的物质的量和溶液的体积。
(4).由于溶液是均一的、稳定的,对于同一浓度的同一溶液来说,不论从中取出多少体积的溶液,其浓度是不变的。
[自主研学]:
1.物质的量浓度的概念:
以单位体积的 所含 的物质的量来表示溶液组成的物理量。
4. 伏加德阿罗定律
[自主研学]:
(1).伏加德阿罗定律的内容:
 在相同
和
下,相同
的任何气体都含有相同
在相同
和
下,相同
的任何气体都含有相同
。
(2).推论:
①.同温同压下,气体的体积之比等于气体的物质的量之比,等于其分子数之比。
②.同温同压下,气体的密度之比等于气体的摩尔质量之比,等于气体的相对原子(分子)质量之比。
③.同温同体积下,气体的压强之比等于气体的物质的量之比,等于其分子数之比。
[质疑激趣]:初中学习过用质量分数表示溶液的浓度,应用起来不方便,为了方便现在采用一种新的表示溶液浓度的方法--“物质的量浓度”。“物质的量浓度”是怎样十分方便地表示溶液浓度的?
3. 气体摩尔体积
[自主研学]:
(1).气体摩尔体积的概念:
将一定的温度和压强下, 叫做气体摩尔体积,符号: ,单位: 。
 (2).气体摩尔体积的计算公式:
(2).气体摩尔体积的计算公式:
由气体摩尔体积的概念可推知气体摩尔体积的计算公式: 。
(3).标准状况是指温度为 、压强为 的状况,简写: 。
(4).标准状况下的气体摩尔体积:
在标准状况下,气体摩尔体积约为 。它是特定条件下的气体摩尔体积。
特别提示:
(1).决定物质体积的因素:
决定物质体积的因素有:①物质所含微粒的数目,②物质所含微粒的大小,③物质所含微粒间的平均距离。对于固体和液体物质来说:“③”物质所含微粒间的平均距离非常小,可忽略不计,它们的体积主要决定于“①”物质所含微粒的数目和“②”物质所含微粒的大小。而对于气体物质来说:“②”物质所含微粒的大小比“③”物质所含微粒间的平均距离小得多,气体物质的体积主要决定于“①”物质所含微粒的数目和“③”物质所含微粒间的平均距离。又温度与压强的大小决定气体物质所含微粒间的平均距离的大小,所以,在温度与压强一定的条件下,当气体分子数相同时,任何气体物质的体积是基本相同的。
(2).物质的宏观量--物质的质量(m)和气体的体积(V)与微观量--物质所含微粒的数目(N)的关系:
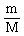
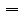 n
n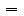

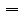
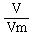
由此,.物质的宏观量--物质的质量(m)和气体的体积(V)与微观量--物质所含微粒的数目(N),通过“物质的量”这一物理量,建立起了桥梁
2. 摩尔质量
(1).定义: ,
符号: ,单位: ,在数值上等于该物质的
或 。
(2).物质的量(n)、物质的质量(m)和摩尔质量(M)之间的关系:
M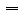
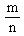
特别提示:
(1).物质的质量、摩尔质量、相对原子(分子)质量的区别与联系
|
物理量 |
物质的质量(m) |
摩尔质量(M) |
相对原子质量(Ar) |
|
概念 |
物体所含物质多少的物理量 |
单位物质的量的物质的质量 |
一种元素的一个原子的质量同一种碳原子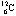 的 的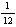 质量的相比所得数值 质量的相比所得数值 |
|
单位 |
g |
g•mol- |
1 |
|
联系 |
①m=nM |
||
|
②摩尔质量在数值上等于该物质的相对原子(分子)质量 |
(2).物质的质量(m)、物质的量(n)、粒子数(N)三者之间的关系:
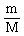
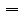 n
n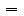

[质疑激趣]:单位物质的量的物质所具有的质量称为该物质的摩尔质量,那么单位物质的量的气体所具有的体积又称为什么?
[自主研学]:
1. 1mol物质的质量
虽然,1mol任何不同物质所含微粒数目是相同的,都是 个,但由
于不同粒子的质量不同,因而,1mol不同物质的质量也是 的。分析课本P21表
1-3-1得:1mol任何物质的质量,都是以克为单位,在数值上等于它的
或 。
2.物质的量(n)、阿伏加德罗常数(NA)与物质所含的微粒数(N)之间的关系:
 n
n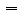

[自主研学]:
由此,3.01×1023个O2的物质的量为 ,9.03×1023个铁原子的物质的量为
。2molH2O中含有 个水分子,含
个氢原子,含有 个电子。可见:
“物质的量”表示含有一定数目粒子的集体,是用
作为标准来衡量 的物理量。
[质疑激趣]:一定质量或一定体积的物质与一定数目微粒的集体(物质的量),究竟有三什联系?
6.02×1023mol-只是阿伏加德罗常数的近似值,其真实值为
。由此看来,
就是定义“1mol”的标准。
[质疑激趣]: 1mol 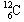 含有6.02×1023个
含有6.02×1023个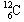 ,2mol
,2mol 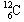 含有2×6.02×1023个
含有2×6.02×1023个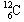 ,则物质的量(n)、阿伏加德罗常数(NA)与物质所含的微粒数(N)之间的关系怎样?
,则物质的量(n)、阿伏加德罗常数(NA)与物质所含的微粒数(N)之间的关系怎样?
2.物质的量及其单位--摩尔(简称: ,符号: )
[自主研学]:
(1).1mol含义的规定:
 国际规定:1mol任何微粒所含的微粒数与
所含的碳原子数相等。
国际规定:1mol任何微粒所含的微粒数与
所含的碳原子数相等。
(2).0.012Kg 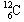 所含的碳原子数约为
(试计算之,其中一个
所含的碳原子数约为
(试计算之,其中一个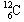 的质量约为1.977×10-26Kg)。
的质量约为1.977×10-26Kg)。
(3).阿伏加德罗常数:

 称为阿伏加德罗常数,符号:
。实际上
称为阿伏加德罗常数,符号:
。实际上
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com