
题目列表(包括答案和解析)
3.下列反应一定是氧化还原反应的是
A.化合反应 B.分解反应 C.复分解反应 D.置换反应
2.下列反应属于氧化还原反应的是
 A.Fe2O3+3CO
A.Fe2O3+3CO 2Fe+3CO2
B.NH4CL
2Fe+3CO2
B.NH4CL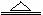 NH3 +HCl
NH3 +HCl
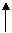 C.2NaHCO3
C.2NaHCO3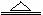 Na2CO3+CO2
+H2O D.Cu2(OH)2CO3
Na2CO3+CO2
+H2O D.Cu2(OH)2CO3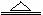 2CuO+CO2 +H2O
2CuO+CO2 +H2O
1.氧化还原反应的实质是
A.元素化合价发生变化 B.反应中有氧原子的得失
C.反应中有电子得失或共用电子对的偏移 D.反应后生成新物质
23.已知:SO2+2H2S=3S+2H2O,其中氧化产物和还原产物的质量比为2:1。25℃时,向体积为 V L的真空容器内通人 n mol SO2和 m mol H2S。
(1)若n=2,则当m = 时,反应后容器内气体的密度最小。
(2)若2n>m时,则反应后氧化产物和还原产物的质量差为 g。
(3)若 5n=m,且反应后氧化产物和还原产物的质量和为48g时,则 n+ m= 。
22.取一定量的Na2SO4和Na2CO3的混合物溶于水后配成1L溶液,取出100mL,加入足量的氯化钡溶液,滤出沉淀,加入足量的盐酸,沉淀部分溶解且放出标况下的气体1.12L;将剩余沉淀滤出,洗涤,干燥,得沉淀 2.33g,求原溶液中钠离子的物质的量浓度。
21.(11分)实验室有一瓶长久放置的亚硫酸钠,为了检验此瓶亚硫酸钠是否部分被氧化及测定亚硫酸钠的质量分数,有学生设计了下面实验,根据实验步骤填写下列空格。
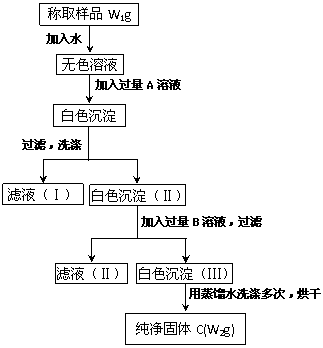
(l)加入的A是 ,应该加入过量的A的理由是
;检验A是否过量的方法是
 加入A发生反应的离子方程式是
。
加入A发生反应的离子方程式是
。
 (2)加入的
B是 ,应稍过量的理由是
;加入B发生反应的离子方程式是
。
(2)加入的
B是 ,应稍过量的理由是
;加入B发生反应的离子方程式是
。
(3)为了检验沉淀(Ⅲ)是否洗净,在最后几滴洗涤液中加人 ,
若 ;表示沉淀已经洗净。
 (4)含亚硫酸钠的质量分数计算式为
。
(4)含亚硫酸钠的质量分数计算式为
。
(5)当W1与W2的关系式为 时,表明亚硫酸钠已被全部氧化。
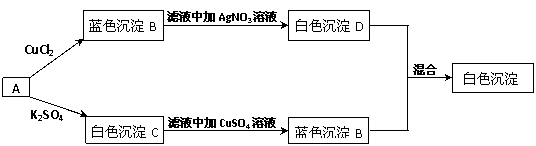
20. (6分)有一学生取两份A溶液做实验,实验步骤和实验现象如下所示(C不考虑是微溶物)。
(6分)有一学生取两份A溶液做实验,实验步骤和实验现象如下所示(C不考虑是微溶物)。
|
|
(1)写出化学式:A. 、B. 、C. 、D. 。
(2)写出下列反应的离子方程式。
 A B
A B
 A C
A C
19. (4分)用浓硫酸吸收三氧化硫可得到发烟硫酸(H2SO4·SO3),某化工厂用1.5t质量分数为
98%的浓硫酸吸收三氧化硫制成发烟硫酸,再与水混合可得密度为1.84g/cm3、质量分数为98
%的H2SO4 t。
(4分)用浓硫酸吸收三氧化硫可得到发烟硫酸(H2SO4·SO3),某化工厂用1.5t质量分数为
98%的浓硫酸吸收三氧化硫制成发烟硫酸,再与水混合可得密度为1.84g/cm3、质量分数为98
%的H2SO4 t。
18. (4分)有K2SO4、H2SO4、NaOH三瓶未贴标签的溶液,如何只用酚酚一种试剂加以鉴别?
17.(4分)某溶液中可能存在下列离子中的一种或几种: CO32- 、SO32-、SO42-、Cl-
(1)当溶液中有大量H+存在时,溶液中不可能有较多的 。
(2)当溶液中有大量 Ba2+存在时,溶液中不可能有较多的 。
(3)当溶液中有大量一价 (阳离子)存在时,四种离子都不可能大量存在。
(4)当溶液中通人 C12时, (阴离子)可被氧化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com