
题目列表(包括答案和解析)
6. 下列能表示二氧化硫被还原的反应是
下列能表示二氧化硫被还原的反应是
A.SO2+2H2O+CL2===H2SO4+2HCL B.SO2+H2S===2H2O+3S
C.SO2+2NaOH===Na2SO3+H2O D.SO2+Na2CO3===Na2SO3+CO2
5. “生氢剂”氢化钠(NAH)与水反应的的化学方程式为:NaH+H2O===NaOH+H2 ,其中,水的作用是
“生氢剂”氢化钠(NAH)与水反应的的化学方程式为:NaH+H2O===NaOH+H2 ,其中,水的作用是
A.既是氧化剂又是还原剂 B.还原剂
C.氧化剂 D.催化剂
4.下列说法不正确的是
A.氧化还原反应都是化合反应 B.中和反应都是复分解反应
C.分解反应中的反应物都是一种 D.单质都是同种元素组成的纯净物
3.下列反应进行分类时,既属于氧化还原反应又属于化合反应的是
 A.Zn+H2SO4===ZnSO4+H2
B.CaO+H2O===Ca(OH)2
A.Zn+H2SO4===ZnSO4+H2
B.CaO+H2O===Ca(OH)2
 C.2KCLO3
C.2KCLO3 2KCL+3O2
D.H2+CL2
2KCL+3O2
D.H2+CL2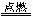 2HCL
2HCL
2.对溶液中的离子反应存在下列几种说法,其中正确的是
A.不可能是氧化还原反应 B.只能是复分解反应
C.可能是置换反应 D.一定是置换反应
1.人体血红蛋白中含有Fe2+离子,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+离子转变成Fe3+离子,生成高铁血红蛋白而丧失与O2结合的能力。服用维生素C可缓解亚硝酸盐的中毒,则维生素C具有
A.氧化性 B.还原性 C.酸性 D.碱性
22、

 (8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2 ;
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2 ;
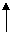 ②Cu+2H2SO4(浓)
②Cu+2H2SO4(浓) CuSO4+SO2 +2H2O。试回答下列问题:
CuSO4+SO2 +2H2O。试回答下列问题:
⑴反应①中 元素被还原,反应②中 元素被还原。(填元素符号)

 ⑵当反应①生成2g
H2时,消耗H2SO4的质量是 g 。
⑵当反应①生成2g
H2时,消耗H2SO4的质量是 g 。


 ⑶反应②中生成32g
SO2气体时,消耗H2SO4的质量是
g ,其中有 g H2SO4作为氧化剂被还原。
⑶反应②中生成32g
SO2气体时,消耗H2SO4的质量是
g ,其中有 g H2SO4作为氧化剂被还原。
21、 (8分)现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲:
(8分)现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲: 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:
 ⑴甲中有 ;乙中有 。(填序号)
⑴甲中有 ;乙中有 。(填序号)

 ⑵由Fe
⑵由Fe 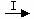 Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 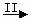 Fe 可知,欲实现I反应过程应从
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从
中找物质。
Fe 可知,欲实现I反应过程应从
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从
中找物质。
 ⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。
⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。



 +
=====
+
+
=====
+
⑷一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:
 4X+5O2
4X+5O2 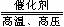 4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
20、



 (6分)已知H2O2中的氧元素呈现 -1价,H2O2分解(催化剂作用下)时可得到H2O和O2,表示该反应的化学方程式为
。根据氧化还原反应中的价态变化规律,推测H2O2在反应中:
(6分)已知H2O2中的氧元素呈现 -1价,H2O2分解(催化剂作用下)时可得到H2O和O2,表示该反应的化学方程式为
。根据氧化还原反应中的价态变化规律,推测H2O2在反应中:
⑴若作还原剂时,其被氧化后得到的产物是 。
 ⑵若作氧化剂时,其被还原后得到的产物是
。
⑵若作氧化剂时,其被还原后得到的产物是
。
19、
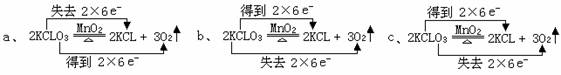
 (8分)对于实验室制取O2的反应:2KCLO3
(8分)对于实验室制取O2的反应:2KCLO3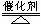 2KCL+3O2 ,其电子转移的方向和数目的标法有以下几种,你认为正确的是
(填序号)
2KCL+3O2 ,其电子转移的方向和数目的标法有以下几种,你认为正确的是
(填序号)



 该反应中,
是氧化剂,
是还原剂,MnO2是
剂。
该反应中,
是氧化剂,
是还原剂,MnO2是
剂。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com