
题目列表(包括答案和解析)
1. 毒品有害人体健康,危害社会稳定。“摇头丸”是国家严令禁止的毒品之一,其化学式为C9H13N ,有关该物质的下列说法中,不正确的是( )
A. 组成该物质各元素的质量比为9:13:1
B. 该物质的相对分子质量为135
C. 该物质为三种元素组成
D. 该物质属于有机物
3. 综合应用
例6. (2005年维坊模拟题)向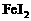 溶液中不断通入
溶液中不断通入 ,溶液中
,溶液中 、
、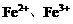 等粒子的物质的量随
等粒子的物质的量随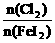 (即
(即 与
与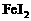 的物质的量之比)的变化可用下图简单表示。
的物质的量之比)的变化可用下图简单表示。
分析图中信息,完成下列各题:
(1)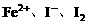 的还原性由弱到强的顺序是_____________;
的还原性由弱到强的顺序是_____________;
(2)当_____________时,(填写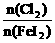 的取值范围),发生反应的离子方程式是
的取值范围),发生反应的离子方程式是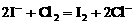 ;
;
(3)用一个离子方程式表示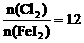 时的反应_____________;
时的反应_____________;
 (4)当
(4)当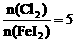 时,溶液中
时,溶液中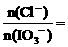 _____________。
_____________。

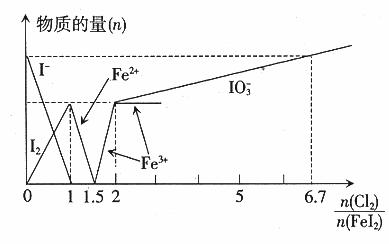
解析:(1)根据图象可知,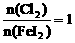 时,
时,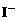 全部氧化为
全部氧化为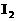 ;
;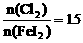 时,
时,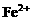 全部氧化为
全部氧化为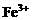 ;
;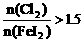 时,I2全部氧化为
时,I2全部氧化为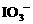 。因此
。因此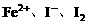 的还原性由弱到强的顺序是
的还原性由弱到强的顺序是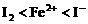 。
。
(2)由(1)的分析可知,当发生反应的离子方程式为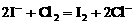 时,
时, 。
。
(3)当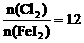 时,即
时,即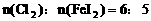 ,此时
,此时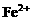 部分氧化为
部分氧化为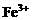 。根据电子得失守恒,该反应的离子方程式为:
。根据电子得失守恒,该反应的离子方程式为: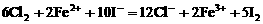 。
。
(4)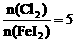 时,
时,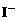 被氧化为I2和
被氧化为I2和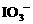 ,设
,设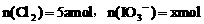 ,则
,则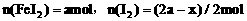
根据电子得失守恒,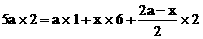
 解得
解得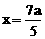
因此

2. 优先还原原理
一种还原剂与多种氧化剂发生反应时,还原剂优先还原氧化性最强的氧化剂,待其完全被还原后,多余的还原剂再依次还原次强的氧化剂。常见的有:
 (1)向含有
(1)向含有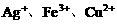 的混合液中加入铁粉,因氧化性
的混合液中加入铁粉,因氧化性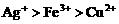 ,
, 先还原
先还原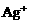 。
。
 (2)镁条在O2、N2或CO2、O2混合气中燃烧,因氧化性
(2)镁条在O2、N2或CO2、O2混合气中燃烧,因氧化性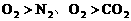 ,Mg先还原O2。
,Mg先还原O2。
(3)铁粉与稀硝酸反应,因氧化性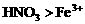 ,若铁粉足量,先发生反应:
,若铁粉足量,先发生反应: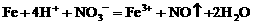 ,后发生的反应:
,后发生的反应: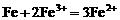 。
。
例4. (2000年全国高考理综试题)在氯化铁、氯化铜和盐酸混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液中存在较多的阳离子是( )
A. 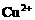 B.
B.
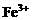 C.
C.
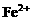 D.
D.
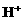
解析:剩余固体能被磁铁吸引,说明反应后有 剩余,结合氧化性
剩余,结合氧化性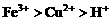 ,可知
,可知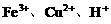 与Fe均反应完,反应后溶液中存在较多的阳离子是
与Fe均反应完,反应后溶液中存在较多的阳离子是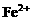 。答案为C项。
。答案为C项。
例5. (2004年上海高考化学试题)在含有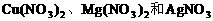 的溶液中加入适量锌粉,首先置换出的是( )
的溶液中加入适量锌粉,首先置换出的是( )
A. Mg B. Cu C. Ag D. H2
解析:因氧化性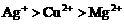 ,Zn先还原
,Zn先还原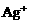 ,首先置换出的是Ag。答案为C项。
,首先置换出的是Ag。答案为C项。
1. 优先氧化原理
一种氧化剂与多种还原剂发生反应时,氧化剂优先氧化还原性最强的还原剂,待其完全被氧化后,多余的氧化剂再依次氧化次强的还原剂。常见的有:
(1)向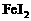 溶液中加入溴水,因还原性
溶液中加入溴水,因还原性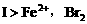 先氧化
先氧化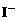 ,待
,待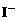 完全被氧化后再氧化
完全被氧化后再氧化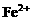 。若
。若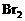 少量,只氧化
少量,只氧化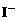 ,离子方程式为:
,离子方程式为: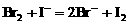 ;若
;若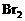 过量,
过量,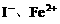 全部被氧化,离子方程式为:
全部被氧化,离子方程式为: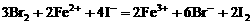 。
。
(2)向 溶液中同时加入铁粉和铜粉,因还原性
溶液中同时加入铁粉和铜粉,因还原性 先氧化Fe。
先氧化Fe。
(3)向含有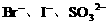 的混合液中通入
的混合液中通入 ,因还原性大小顺序为
,因还原性大小顺序为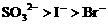 ,
, 先氧化
先氧化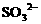 。
。
例1. (1999年全国高考化学试题)制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为: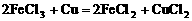 。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是( )
A. 烧杯中有铜无铁
B. 烧杯中有铁无铜
C. 烧杯中铁、铜都有
D. 烧杯中铁、铜都无
解析:因还原性 先氧化Fe,只有Fe反应完后,剩余
先氧化Fe,只有Fe反应完后,剩余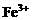 才能再氧化Cu,先后发生反应的离子方程式为:
才能再氧化Cu,先后发生反应的离子方程式为: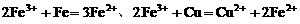 。
。 的量不足时可能有铜无铁或铁、铜都有,
的量不足时可能有铜无铁或铁、铜都有, 足量时无铁无铜,有铁无铜是不可能出现的。答案为B项。
足量时无铁无铜,有铁无铜是不可能出现的。答案为B项。
例2. (2002年江苏高考大综合试题)在100mL含等物质的量的HBr和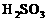 的溶液里通入0.01molCl2,有一半
的溶液里通入0.01molCl2,有一半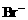 变为
变为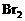 (已知
(已知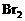 能氧化
能氧化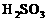 )。原溶液中
)。原溶液中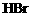 和
和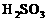 的浓度都等于( )
的浓度都等于( ) 。
。
 A. 0.0075 B.
0.008 C.
0.075 D.
0.08
A. 0.0075 B.
0.008 C.
0.075 D.
0.08
 解析:
解析: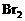 能氧化
能氧化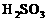 ,可知还原性
,可知还原性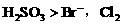 先氧化
先氧化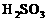 ,再氧化
,再氧化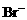 。先后发生反应的离子方程式为:
。先后发生反应的离子方程式为: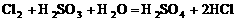 ,
,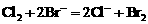 。设原溶液中HBr和
。设原溶液中HBr和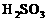 的浓度都为c,结合方程式有:
的浓度都为c,结合方程式有: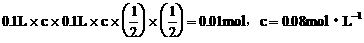 。答案为D项。
。答案为D项。
例3. (2003年上海高考化学试题)向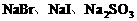 混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
混合液中,通入一定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )
A. 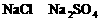
B. 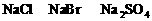
C. 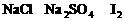
D. 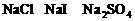
解析:因还原性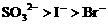 ,
, 先氧化
先氧化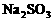 ,若
,若 有剩余,再氧化
有剩余,再氧化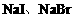 。观察选项可发现
。观察选项可发现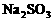 全被氧化成
全被氧化成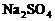 ,只需考虑
,只需考虑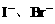 反应情况。由于通入的
反应情况。由于通入的 是一定量的,当
是一定量的,当 足量时,
足量时, 与三者都反应,剩余物质组成为选项A;当
与三者都反应,剩余物质组成为选项A;当 不足量时,Cl2与
不足量时,Cl2与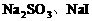 反应生成
反应生成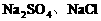 ,剩余物质组成为选项B。不可能出现D选项情况。答案为A、B项。
,剩余物质组成为选项B。不可能出现D选项情况。答案为A、B项。
(六)氧化还原反应中的规律
1、电子守恒规律:在任何氧化还原反应中,氧化剂得到的电子总数与还原剂失去的电子总数相等。此规律应用于解氧化还原反应的计算题、氧化还原反应方程式的配平。
2、先后律:当一种氧化剂(还原剂)同时遇到几种还原剂(氧化剂)时,还原剂(氧化剂)按还原性(氧化性)的强弱顺序依次被氧化(还原)。
3、临位转化规律:在一般情况下,大多数氧化还原反应转化,氧化剂和还原剂的价态变化是临位转化。例如:H2S与浓H2SO4的反应,H2S一般被氧化成S,浓硫酸一般被还原成SO2.
4、只靠拢不交叉规律:同种元素不同价态的原子间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而绝不会出现高价态变低,低价态变高的交叉现象。
5、价态律:元素处于最高价态时,只有氧化性而无还原性。例如:MnO4-、Fe3+等。元素处于最低价态时,只有还原性而无氧化性。例如:S2-、I-等。元素处于中间价态时,即能表现氧化性又能表现还原性。例如:H2O2、Fe2+等。
[巩固练习]
1、下列反应一定属于氧化还原反应的是( )
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
2、下列变化中,需要加入氧化剂的是( )
A.SO2→SO3 B.HCl→H2
C.FeCl2→FeCl3 D.Fe2O3→Fe
3.(2003.上海春季高考)苹果汁是人们喜爱的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止此种现象发生,这说明维生素C具有 ( )
A. 氧化性 B.还原性 C. 碱性 D.酸性
4、下列反应中,盐酸只作氧化剂的是( )
A.Zn+2HCl=ZnCl2+H2↑
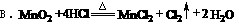
C.Cl2+H2O=HCl+HClO
D.CaCO3+2HCl=CaCl2+H2O+CO2
5、下列叙述中,正确的是( )
A.同一反应中,氧化剂的氧化性比氧化产物的氧化性强
B.同一反应中,还原剂的还原性比还原产物的还原性弱
C.由X原子变成X2+的反应是氧化反应
D.由X原子变成X2+,需加入还原剂
6.下列叙述正确的是 ( )
A. 在氧化还原反应中,失去电子的物质,所含元素化合价降低
B. 在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
C. 凡是有元素化合价升降的化学反应都是氧化还原反应
D. 氧化还原反应的本质是电子的得失或偏移
7、下列关于氧化还原反应的叙述中正确的是( )
A.金属单质在反应中只作为还原剂
B.非金属单质在反应中只作为氧化剂
C.金属原子失电子越多,还原性越强
D.Cu2+比Fe2+氧化性强,Fe比Cu还原性强
8、某反应的化学方程式为:aFeCl2+bKNO3+cHCl=dFeCl3+eKCl+fX+gH2O,若b=1,d=3,则X的化学式为( )
A.N2 B.NO C.NO2 D.NH4Cl
9、下列对盐酸的有关性质叙述正确的是( )
A.有酸性,没有氧化性和还原性
B.有酸性和氧化性,没有还原性
C.有酸性和还原性,没有氧化性
D.有氧化性和还原性,还有酸性
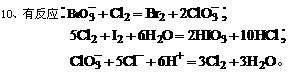
依据上述方程式,下列微粒氧化能力排列顺序正确的是( )
A.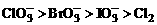 B.
B.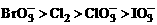
C. D.
D.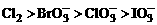
11、在8NH3+3Cl2=N2+6NH4Cl反应中,若有21.3g Cl2参加反应,则被氧化的NH3的质量为( )
A.13.6g B.10.2g C.6.8g D.3.4g
12、 离子在一定条件下可把Mn2+氧化成
离子在一定条件下可把Mn2+氧化成 ,若反应后
,若反应后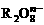 变成
变成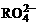 ,又知反应中氧化剂与还原剂的离子个数比为5:2,则
,又知反应中氧化剂与还原剂的离子个数比为5:2,则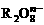 中R元素的化合价为( )
中R元素的化合价为( )
A.+3 B.+5 C.+6 D.+7
13、一定条件下硝酸铵受热分解的未配平化学方程式为:NH4NO3--HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为( )
A.1:1 B.5:4 C.5:3 D.3:5
14、下列氧化还原反应中,水既不是氧化剂又不是还原剂的是( )
A . 2F2+2H2O==4HF+O2 B.C+H2O==CO+H2
C. CO+H2O==CO2+H2 D. C12+H2O== HCI+HClO
15、下列粒子:①Fe2+ ②Na③SO2 ④H+ ⑤C1- ⑥S⑦Cu2+(用序号回答)
只有氧化性的是 ;只有还原性的是 ;既有氧化性又有还原性的是
16、已知反应:AgF+Cl2+H2O→AgCl+AgClO3+HF+O2(未配平),不必配平此方程式判断:
(1)若Cl2的系数为a,则AgF的系数为_____,判断的依据是________。
(2)若AgClO3的系数为b,O2的系数为c,则AgCl的系数为_______,判断的依据是________。
(3)在水溶液中NH2H5+离子作Fe3+还原成Fe2+,发生如下反应:
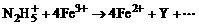 ,作为N2H5+的氧化产物Y可能是(填写化学式)________。
,作为N2H5+的氧化产物Y可能是(填写化学式)________。
17、三聚氰酸C3N3(OH)3可用于消除汽车尾气中的氮氧化物(如NO2)。当加热至一定温度时,它发生如下分解:C3N3(OH)3=3HNCO,HNCO(异氰酸,其结构是H-N=C=0)能和NO2反应生成N2、CO2和H2O。写出HNCO和NO2反应的化学方程式。分别指明化合物中哪种元素被氧化?哪种元素被还原?标出电子转移的方向和数目。
(五)、氧化性和还原性及其强弱的判断方法
常见的氧化剂:KMnO4,浓H2SO4,浓、稀HNO3,Cl2
常见的还原剂:H2、CO、C、大多数金属。
1、氧化剂的氧化性>氧化产物的氧化性
还原剂的还原性>还原产物的还原性
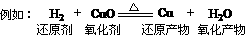
则:还原性:H2>Cu
2、(1)随着金属活动顺序表中金属活动性的减弱,金属的还原性越来越弱,其对应离子的氧化性越来越强.(除Fe3+外)
|
|
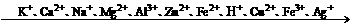
(2)对于非金属单质
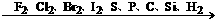 氧化性逐渐减弱
氧化性逐渐减弱
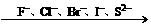 还原性逐渐增强
还原性逐渐增强
3、从反应条件来比较。一般来讲,一组反应中,反应条件越简单,对应反应物的氧化性或还原性越强.
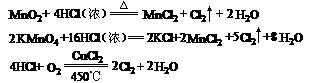
从反应条件可以看出氧化剂的氧化能力:KMnO4>MnO2>O2
4、根据氧化产物的价态高低判断:当变价的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性的强弱。例如:2Fe+3Cl2=2FeCl3 Fe+S=FeS可以判断氧化性Cl2强于S.
[巩固性练习]6、已知 2Fe3+ +2I- =2Fe2+ +I2 ,2Fe2+ +Cl2 =2Fe3+ +2Cl- 则有关离子的还原性强弱顺序为
A.Cl->Fe2+>I- B. Fe2+>I->Cl- C.I->Fe2+>Cl- D.Fe2+>Cl->I-
(四)、氧化还原反应中电子转移的表示方法
●双线桥法
1、双箭号从反应物指向生成物,箭号起止所指的均为同一种元素。
2、线上标出得失电子的情况及价的升降、被氧化或被还原等内容。

氧化剂为Fe2O3,还原剂为CO,氧化产物为CO2,还原产物为Fe。
●单线桥法
1、箭号由还原剂中失电子的元素指向氧化剂中得电子的元素;
2、线上只标出转移电子的总数。
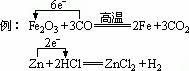
[巩固性练习]5、用双线桥法和单线桥法表示下列氧化还原反应的电子转移。
MnO2+4HCl(浓)==MnCl2+C12↑+2H2O
2NaBr+Cl2===2NaCl+Br2
(三)、氧化还原反应中的有关概念

联系:
氧化剂(具有氧化性)→所含元素化合价降低→得电子→被还原剂还原→发生还原反应→得还原产物。
还原剂(具有还原性)→所含元素化合价升高→失电子→被氧化剂氧化→发生氧化反应→得氧化产物。

巩固性练习:3、铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾.更强,本身在反应中被还原为Fe3+
化学反应方程式为:2Fe(NO3)3+16NaOH+3C12=2Na2FeO4+6NaNO3+8NaCl+6H2O
反应中的氧化剂是 还原剂是 ;反应中 元素被氧化,转移电子总数是
(二) 、从电子转移的角度认识氧化还原反应
|
反应 |
化合价升降 |
电子转移 |
氧化还原情况 |
|
2Na+Cl2==2NaCl |
钠元素 氯元素 |
钠
氯 |
Na发生 反应,被 Cl2发生 反应,被 |
|
H2+Cl2==2HCl |
氢元素 氯元素 |
氢
氯 |
H2发生 反应,被 Cl2发生 反应,被 |
小结:1、从反应前后电子转移的角度看,氧化还原反应是有 的反应;(氧化还原反应的本质)
2、氧化反应是物质 (填“得到”或“失去”)电子的反应;还原反应是物质 (填“得到”或“失去”)电子的反应。
3、氧化还原反应的本质是
4、在氧化还原反应中,失去电子的物质是 ,得到电子的物质是 。
氧化剂: 电子;化合价 ;发生 反应(具有 性);
还原剂: 电子;化合价 ;发生 反应(具有 性)。
5、氧化反应与还原反应同时发生,既对立又统一,在反应中化合价上升和下降总数相等,得到电子和失去电子总数相等。
6、氧化还原反应与四种基本类型反应的关系为:
置换反应全部属于氧化还原反应,复分解反应全部属于非氧化还原反应,
有单质参加的化合反应和有单质生成的分解反应全部属于氧化还原反应。
[巩固性练习]2、对于Cl2+SO2+2H2O==H2SO4+2HCl反应,下列说法正确的是( )
① Cl2是氧化剂②SO2被氧化③Cl2被氧化④Cl2发生还原反应⑤SO2具有还原性⑥Cl2具有氧化性
A .只有①②⑥ B.只有②③④ C.只有②④⑤⑥ D.只有①②④⑤⑥
(一)、从元素化合价升降的角度认识氧化还原反应
|
反应 |
是否氧化 还原反应 |
“得”还是 “失”氧 |
化合价升降 |
氧化还原情况 |
|
C+2CuO==2Cu+CO2 |
|
C 氧, CuO 氧 |
碳元素 铜元素 |
C发生
反应,被 CuO发生 反应,被 |
|
C+H2O==H2+CO |
|
C 氧, H2O 氧 |
碳元素 氢元素 |
C发生
反应,被 H2O发生 反应,被 |
小结:①从反应前后元素化合价是否升降看,氧化还原反应是有 的反应(氧化还原反应的特征);②氧化反应是物质所含元素化合价 (填“升高”或“降低”)的反应;还原反应是物质所含元素化合价 (填“升高”或“降低”)的反应。
[巩固性练习]1、判断下列反应是不是氧化还原反应,若是氧化还原反应,指出什么元素被氧化?什么元素被还原?
a.2CuO+C=2Cu+CO2 b.Cl2+2NaOH=NaCl+NaClO+H2O c.Mg+Cl2=MgCl2 d.KClO3+6HCl=KCl+3Cl2+3H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com