
题目列表(包括答案和解析)
1.溶洞的形成的化学反应为
4.实验室制NO的方法:
3.实验室制NO2的方法:
2.SO2实验室制法:
原理
装置:发生装置同制氢气;
 收集:向 排空气法。
收集:向 排空气法。
检验: ;
干燥:用 作干燥剂
尾气:
实验室制SO2的其他方法:
工业制SO2法:
1.NH3实验室制法:
原理
装置:发生装置同制氧气;
收集:向 排空气法,管口出塞一团棉花的作用 。
检验: a: ;
b: 。
干燥:不能用 、 作干燥剂,因为CaCl2与NH3反应生成CaCl2·8NH3,P2O5能与H2O、NH3反应生成磷酸盐,浓H2SO4与NH3反应生成(NH4)2SO4。通常用碱石灰作干燥剂。
 实验室制NH3的其他方法:
实验室制NH3的其他方法:
尾气:
工业制NH3法:
2. 递变性
(1)与氢气反应:反应条件由易到难;反应程度由剧烈变为缓慢;卤化氢的稳定性逐渐减弱。
(2)与水反应:氟特殊,氯、溴、碘相似。反应的剧烈程度逐渐减弱
(3)卤素单质间的置换反应
Cl2、 Br2 、 I2氧化性: Cl-、Br-、I-还原性 :
有关的离子方程式
3.氯、溴、碘的性质及其变化规律
相似性:(1)与绝大多数金属金属反应反应
(2)一定条件下均可与氢气反应: (3)Cl2、Br2、I2均可与水反应:
(4) 与水反应:
1.常量元素 微量元素
海洋元素 国防金属
2镁的性质:
 镁的化学性质:镁是较活泼的金属,有较强的还原性。在空气中燃烧的化学方程式为
镁的化学性质:镁是较活泼的金属,有较强的还原性。在空气中燃烧的化学方程式为
现象
3.硝酸和硫酸的性质:
浓H2SO4具有3个特性
浓H2SO4和硝酸的化学性质的相似性有
浓、稀H2SO4的粒子组成及氧化性比较
|
|
稀硫酸 |
浓硫酸 |
|
主要粒子 |
|
|
|
与金属反应 |
|
|
|
与碳反应 |
|
|
Ⅰ.氧化性酸和酸的氧化性之别:
a. 氧化性酸是指酸根部分易得电子的酸,是相对于非氧化性酸而言的。例如:硝酸、浓硫酸、次氯酸等
b.酸的氧化性是指酸中的H+具有得电子的性质
Ⅱ.浓硫酸
a.浓硫酸与金属反应一般不产生氢气
b.浓硫酸被还原生成二氧化硫
c.金属被氧化生成金属硫酸盐(变价金属Cu、Fe生成高价盐)
 问题:区别浓、稀H2SO4的方法有哪些?
问题:区别浓、稀H2SO4的方法有哪些?
2.二氧化硫与二氧化碳性质比较
(1)物理性质
相同点: 。
不同点:二氧化碳 气味,二氧化硫 气味;二氧化碳 毒,二氧化硫 毒;二氧化碳 溶于水(1体积水大约溶解 体积气体),二氧化硫 溶于水(1体积水大约溶解 体积气体);二氧化硫 液化。
(2)化学性质
相同点:都是 氧化物。
① 都能和水反应,生成的酸不稳定,只能存在于溶液中。
方程式
 ②都能与碱反应,用量比不同,可以生成两种盐。
②都能与碱反应,用量比不同,可以生成两种盐。
SO2、CO2气体通入澄清石灰水中,都是先 ,当SO2、CO2过量时又 。
SO2与少量和过量NaOH溶液反应的离子方程式
 不同点:
不同点:
①二氧化硫常表现还原性,二氧化碳表现氧化性
举例
二氧化硫能被高锰酸钾、氯水、溴水、碘水等氧化剂氧化,二氧化碳不能。
SO2与溴水、碘水反应的离子方程式
②二氧化硫具有漂白性,能漂白某些有色物质,二氧化碳 能。
③造成环境破坏的原因不同: 形成酸雨, 引起温室效应。
⑤SO2的漂白性:
可使品红或其它有色物质褪色,其褪色原理主要是和有机色质形成不稳定的无色化合物,受热后无色化合物又分解,恢复原来的红色。
注意:常见漂白性物质根据漂白原理的不同,大致可分为三类:
(1)氧化型:漂白剂本身是一种强氧化剂,能将许多有色物质 成无色物质。这种漂白是彻底的,不可逆的。此类物质有:HClO、Ca(ClO)2等次氯酸盐、Na2O2 、H2O2、O3等。
(2)加合型:漂白剂与某些有色物质 成无色物质,但这种无色物质在受热、光照等因素的影响下,会发生分解恢复原色。所以这种漂白可逆、不彻底。此类物质主要是SO2。
注意:SO2不漂白酸碱指示剂。
(3)吸附型:有些物质的固体疏松多孔,具有较大的表面积,可以吸附一些有色物质或有色离子并使之褪色,属物理变化。此类物质有:活性炭、胶体等。
说明:①浓HNO3有较强的氧化性,也能将一些有色物质氧化褪色。如在浓HNO3中滴几滴石蕊试液,先 后立即 。但因HNO3有较强的腐蚀性,不宜用作漂白剂,因此不能说浓HNO3有漂白性。同样,不能笼统地将有褪色能力的物质说成具有漂白性。
②漂白是指使有机色质褪色,使无机色质褪色(如溴水、KMnO4、CuSO4·5H2O)不称为漂白作用。
问题:(1)将二氧化硫分别通入下列溶液中,把产生的现象与其体现的性质填入下表空格中:
|
溶液 |
石蕊试液 |
加有酚酞的氢氧化钠溶液 |
KMnO4酸性溶液 |
溴水 |
品红溶液 |
|
现象 |
 |
|
|
|
|
|
SO2的性质 |
|
|
|
|
|
(2)木炭与热浓硫酸反应的三种产物分别应用什么试剂一一鉴出?


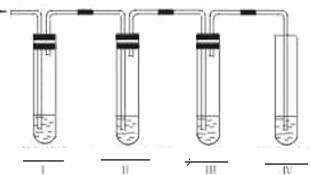
(3)(如上图)碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中,下列有关说法正确的是( )
A.洗气瓶中产生的沉淀是碳酸钡 B.在Z导管出来的气体中无二氧化碳
C.洗气瓶中产生的沉淀是硫酸钡 D.在Z导管口有红棕色气体出现
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com