
题目列表(包括答案和解析)
5.证明淀粉在酶作用下只部分发生了水解的实验试剂是(??)?
A.碘水
B.氢氧化钠溶液、银氨溶液
C.烧碱溶液、新制氢氧化铜溶液
D.碘水、烧碱溶液、氢氧化铜悬浊液
4.下列物质不需水解就能发生银镜反应的是(??)
A.淀粉 B.葡萄糖 C.蔗糖 D.纤维素
3.下列对葡萄糖性质的叙述中错误的是( )。
A.葡萄糖具有醇羟基,能和酸起酯化反应 B.葡萄糖能使溴水褪色
C.葡萄糖能被硝酸氧化 D.葡萄糖能水解生成乙醇
2. 把NaOH溶液和CuSO4溶液加入某人的尿液中,微热后观察到红色沉淀,说明该尿液中含有( )
把NaOH溶液和CuSO4溶液加入某人的尿液中,微热后观察到红色沉淀,说明该尿液中含有( )
A.食醋 B.白酒 C.食盐 D.葡萄糖
2.已知方志敏同志在监狱中写给鲁迅的信是用米汤写的,鲁迅是如何看到信的内容的?
如何设计实验证明淀粉已经水解?如何证明淀粉的水解已经完全?
第一步:
第二步:
大米和高粱等农副产品可以酿酒,植物的秸秆等可以制造酒精?
化学方程式:
[练习]:1.青苹果汁遇碘溶液显蓝色,熟苹果能还原银氨溶液。这说明
A. 青苹果中只含淀粉不含糖类 B. 熟苹果中只含糖类不含淀粉
C. 苹果成熟时淀粉水解为单糖 D. 苹果成熟时单糖聚合成淀粉
糖类化合物的组成与存在
|
|
葡萄糖 |
蔗糖 |
淀粉 |
纤维素 |
|
组成 |
|
|
|
|
|
在自然界中的存在 |
|
|
|
|
人们从食物中摄入淀粉,淀粉在体内 淀粉酶的作用下发生复杂的变化,水解成 葡萄糖。化学反应方程式为
[探究实验1]观察糖类的颜色、状态和水溶性。总结实验现象,讨论完成实验记录表格。
|
|
葡萄糖 |
蔗糖 |
淀粉 |
纤维素 |
|
颜色、状态 |
|
|
|
|
|
水溶性 |
|
|
|
|
有位同学平时老是头晕,到医院检查,医生说是低血糖。那么低血糖是怎么回事?
低血糖患者或不能正常饮食的病人到了医院,医生会给病人滴注葡萄糖;在运动会上,运动员跑完之后,也经常喝葡萄糖来补充营养,那么利用葡萄糖来补充营养的原理是什么呢?1.8g葡萄糖在人体中燃烧生成生成液态的水和二氧化碳气体,放出28.04KJ的热量试写出该反应的热化学方程式
 可是糖也不可吃得太多,否则会患龋齿或糖尿病。那么同学们能用你学过的知识设计一个实验,证明某人是否得了糖尿病吗?
可是糖也不可吃得太多,否则会患龋齿或糖尿病。那么同学们能用你学过的知识设计一个实验,证明某人是否得了糖尿病吗?
[实验2]“葡萄糖的银镜反应”
实验步骤:
现象:
[实验3]“葡萄糖与新制Cu(OH)2的反应”。
实验步骤:
现象:
[实验4]“淀粉的水解反应”
学生完成上述探究实验2-4,记录、讨论完成如下表格:
|
|
现象 |
解释 |
|
探究实验2 |
|
|
|
探究实验3 |
|
|
|
探究实验4 |
|
|
[思考与交流]
1.有一个糖尿病患者去医院检验病情,如果你是一名医生,你将用什么化学原理去确定其病情的轻重?
糖类水解反应,葡萄糖的官能团及其反应,葡萄糖的检验。
[知识与技能]:1.通过各种糖类物质的比较学习,拓展对糖的认识,进而集中于葡萄糖来了解糖类的性质。
2.从丰富的糖类物质中认识糖对人体的重要,以葡萄糖的热化学方程式来显示其作为人体能源物质的价值。
[过程与与方法]:学生在实验探究中分析葡萄糖的官能团,形成从性质推断官能团的基本思维方式。学习科学探究的基本方法,提高科学探究能力。
[情感与态度]:密切化学与生活、人类的联系,激发学生学习化学、了解自身的兴趣。
18. 在浓硝酸中放入铜片:
 (1)反应开始时的化学方程式为________________________。
(1)反应开始时的化学方程式为________________________。
(2)若铜有剩余,则反应快要结束时的化学方程式是。________________________
(3)待反应停止,再加入少量25%的稀硫酸,这是铜片上又有气泡产生,其原因是________________________。
(4)若将12.8 g铜跟一定质量的浓硝酸反应,铜耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________________________,所得气体的平均相对分子质量为______________________________。

17.某研究性学习小组在查阅资料时发现,化工厂常用氨气来检验氯气是否泄漏,于是他们设计实验来探究氯气与氨气之间的反应。该小组设计的实验装置如下图:
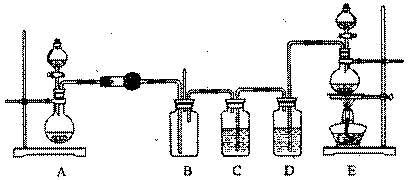
实验可用药品有:a.二氧化锰 b.浓盐酸 c.浓氨水 d .氯化铵 e.碱石灰 f.浓硫酸
g.饱和食盐水 h.NaOH 固体 i.消石灰
请回答下列问题:
( 1 )实验室制备氨气有多种方法。通常用加热固体混合物的方法制备氨气,反应的化学方程式是______________________________________________,本实验中装置A 烧瓶内的固体可选用_______________(填上述给定药品的序号)。
( 2 )装置E 的烧瓶中发生反应的化学方程式是_______________________________.
( 3 )装置D 中盛装的药品是________________(填序号),装置C的作用是__________。
( 4 )通人B 装置的两根导管左边的较长、右边的较短,其目的是___________________。
( 5 )实验中观察到装置B 内出现浓厚的白烟,并在容器壁上凝结成白色固体,将该固体溶于水,所得溶液中离子浓度由大到小的顺序为___________________________________。
( 6 )已知,在水溶液中能发生反应3C12+2NH3 = N2+6HCl,如果氯气过量,一种产物分子的空间构型与NH3 相似,该反应的化学方程式是________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com