
题目列表(包括答案和解析)
15.判断下列示意图是否正确?为什么?

3.核外电子的排布规律
(1)各电子层最多容纳的电子数是2n2(n表示电子层)
(2)最外层电子数不超过8个(K层是最外层时,最多不超过2个);次外层电子数目不超过18个;倒数第三层不超过32个。
(3)核外电子总是尽先排布在能量最低的电子层,然后由里向外从能量低的电子层逐步向能量高的电子层排布。
[练习]14.填写下表:

2.电子总是尽先排布在能量最低的电子层里。
1.在多个电子的原子里,核外电子是分层运动的,又叫电子分层排布。

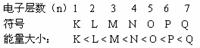
(二)核素
核素:把具有一定数目的质子和一定数目的中子的一种原子称为核素。一种原子即为一种核素。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。
或:同一种元素的不同核素间互称为同位素。
(1)两 同:质子数相同、同一元素
(2)两不同:中子数不同、质量数不同
(3)属于同一种元素的不同种原子
[练习]
12.在过氧化钠中含有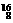
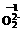 ,各数字所表示的意义是:16 、8 、2- 、2 、-1 。
,各数字所表示的意义是:16 、8 、2- 、2 、-1 。
13.元素X的一种同位素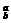 X,元素Y的一种同位素
X,元素Y的一种同位素 Y,已知a>c,b>d,则元素X和Y的相对原子质量的大小关系为( )
Y,已知a>c,b>d,则元素X和Y的相对原子质量的大小关系为( )
A.X>Y B.X=Y
C.X<Y D.不能确定
第二节 元素周期律
(一)原子的构成:
(1)原子的质量主要集中在原子核上。
(2)质子和中子的相对质量都近似为1,电子的质量可忽略。
 (3)原子序数 = 核电核数 = 质子数 = 核外电子数
(3)原子序数 = 核电核数 = 质子数 = 核外电子数
(4)质量数(A)=质子数(Z)+中子数(N)
|
 X来表示一个质量数为A,质子数为Z的具体的X原子。
X来表示一个质量数为A,质子数为Z的具体的X原子。

[练习]
10.下列叙述中正确的是( )
A.氢有三种同位素,即有三种氢原子 B.所有元素的原子核均由质子和中子构成
C.具有相同的核外电子数的粒子,总称为元素
D.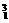 H是一种同位素
H是一种同位素
11.在 Li、
Li、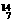 N、
N、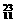 Na、
Na、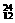 Mg、
Mg、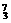 Li、
Li、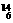 C中:
C中:
(1) 和 互为同位素。
(2) 和 质量数相等,但不能互称同位素。
(3) 和 的中子数相等,但质子数不相等,所以不是同一种元素。
(二)卤族元素:
1. 原子结构 相似性:最外层电子数相同,都为_________个
原子结构 相似性:最外层电子数相同,都为_________个
递变性:从上到下,随着核电核数的增大,电子层数增多
2.卤素单质物理性质的递变性:(从F2到I2)
(1)卤素单质的颜色逐渐加深;(2)密度逐渐增大;(3)单质的熔、沸点升高
3.卤素单质与氢气的反应: X2 + H2 = 2 HX

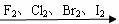
卤素单质与H2 的剧烈程度:依次减弱 ; 生成的氢化物的稳定性:依次减弱
4.卤素单质间的置换
2NaBr +Cl2 =2NaCl + Br2 氧化性:Cl2________Br2 ; 还原性:Cl-_____Br-
2NaI +Cl2 =2NaCl + I2 氧化性:Cl2_______I2 ; 还原性:Cl-_____I-
2NaI +Br2 =2NaBr + I2 氧化性:Br2_______I2 ; 还原性:Br-______I-
结论: 
单质的氧化性:依次减弱,对于阴离子的还原性:依次增强
5. 非金属性的强弱的判断依据:
1. 从最高价氧化物的水化物的酸性强弱,或与H2反应的难易程度以及氢化物的稳定性来判断。
2. 同主族从上到下,金属性和非金属性的递变:
同主族从上到下,随着核电核数的增加,电子层数逐渐增多,原子核对最外层电子的引力逐渐________,原子得电子的能力________,失电子的能力________,即非金属性逐渐_______,金属性逐渐__________。
3. 原子结构和元素性质的关系:
原子结构决定元素性质,元素性质反应原子结构。
同主族原子结构的相似性和递变性决定了同主族元素性质的相似性和递变性。
[练习]
7.a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2 B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2 D.H2、HCl、HBr、Cl2
8.某溶液中Cl-、Br-、I-三种离子物质的量之比是1︰2︰3,通入一定量Cl2充分反应后,该比值为3︰2︰1,则通入Cl2和原溶液中I-离子物质的量之比是( )
A.1︰1 B.1︰2 C.1︰3 D.1︰4
9.砹(At)原子序数85,与F、Cl、Br、I同族,推测砹或砹的化合物不可能具有的性质是( )
A.砹是有色固体 B.非金属性:At>I
C.HAt非常稳定 D.I2 可以At从At的可溶性的盐溶液置换出来。
(一)碱金属元素:
1. 原子结构 相似性:最外层电子数相同,都为_______个
原子结构 相似性:最外层电子数相同,都为_______个
递变性:从上到下,随着核电核数的增大,电子层数增多
2.
 碱金属化学性质的相似性:
碱金属化学性质的相似性:
4Li + O2 Li2O 2Na + O2 Na2O2
2 Na + 2H2O = 2NaOH + H2↑ 2K + 2H2O = 2KOH + H2↑
2R + 2 H2O = 2 ROH + H2 ↑
产物中,碱金属元素的化合价都为+1价。
结论:碱金属元素原子的最外层上都只有_______个电子,因此,它们的化学性质相似。
3.碱金属化学性质的递变性:
递变性:从上到下(从Li到Cs),随着核电核数的增加,碱金属原子的电子层数逐渐增多,原子核对最外层电子的引力逐渐减弱,原子失去电子的能力增强,即金属性逐渐增强。所以从Li到Cs的金属性逐渐增强。
结论:1)原子结构的递变性导致化学性质的递变性。
 2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
2)金属性强弱的判断依据:与水或酸反应越容易,金属性越强;最高价氧化物对应的水化物(氢氧化物)碱性越强,金属性越强。
4.碱金属物理性质的相似性和递变性:
1)相似性:银白色固体、硬度小、密度小(轻金属)、熔点低、易导热、导电、有展性。
2)递变性(从锂到铯):
①密度逐渐增大(K反常) ②熔点、沸点逐渐降低
3)碱金属原子结构的相似性和递变性,导致物理性质同样存在相似性和递变性。
小结:碱金属原子结构的相似性和递变性,导致了碱金属化学性质、物理性质的相似性和递变性。
递变性:同主族从上到下,随着核电核数的增加,电子层数逐渐_______,原子核对最外层电子的引力逐渐________,原子失去电子的能力________,即金属性逐渐_______。
[练习]
4.关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.依Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
C.随核电荷数递增,氢氧化物碱性增强
D.随电子层数增加,原子半径增大,金属还原性增强
5.关于钠和钾元素的比较中,不正确的是( )
A.钾原子失电子比钠原子容易 B.钾离子氧化性比钠离子强
C.钾与水反应比钠剧烈 D.KOH碱性比NaOH强
6.下列关于碱金属的叙述中正确的是( )
A.碱金属单质与水反应都能生成碱和H2
B.碱金属单质都是质软、熔点低、密度均小于1的轻金属
C.碱金属元素随原子半径增大,原子核吸引最外层电子的能力增强
D.碱金属单质在空气中燃烧都生成过氧化物
3.已知A元素原子的最外层电子数是次外层电子数的3倍,B元素原子的次外层电子数是最外层电子数的2倍,则A、B元素
A.一定是第二周期元素 B.一定是同一主族元素
C.可能是二、三周期元素 D.可以相互化合形成化合物
2.若某ⅡB族元素原子序数为x,那么原子序数为x+1的元素位于
A.ⅢB族 B.ⅢA族 C.ⅠB族 D.ⅠA族
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com