
题目列表(包括答案和解析)
4. 化学平衡必须是可逆反应在一定条件下建立的,不同的条件将建立不同的化学平衡状态;通过反应条件的控制,可以改变或稳定反应速率,可以使可逆反应朝着有利于人们需要的方向进行,这对于化学反应的利用和控制具有重要意义。
同时,在具体工业生产中,既要考虑反应的速率也要考虑反应所能达到的限度。如工业合成氨时,就要通过控制反应器的温度和压强,使反应既快又能达到较大的限度。
[练习]
3.化学反应的特征:
动:动态平衡 等:υ(正)=υ(逆)
定:各组分的浓度不再发生变化 变:如果外界条件的改变,原有的化学平衡状态将被破坏。
2. 对于可逆反应,在一定条件下进行到一定程度时,正反应速率和逆反应速率相等,反应物和生成物的浓度不再发生变化,反应达到化学平衡状态。
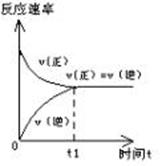

反应开始: υ(正)>υ(逆)
反应过程中:υ(正)逐渐减小,υ(逆)逐渐增大;反应物浓度减小,生成物浓度增大
平衡时: υ(正)=υ(逆);各组分的浓度不再发生变化
1. 当一个可逆反应进行到正向反应速率与逆向反应速率相等时,反应物和生成物的浓度________,达到表面上静止的一种“_____________”,这就是这个反应所能达到的限度。
20.下列措施肯定能使化学反应速率增大的是( )
A.增大反应物的量 B.增大压强 C.升高温度 D.使用催化剂
2.影响化学反应速率的因素有浓度、温度、催化剂,还有压强(对有气体物质的反应)、光波、电磁波、超声波、溶剂、固体的表面积等。
通常浓度越大(气体或溶液),反应速率越快;温度越高,反应速率越快;压强越大,反应速率越快(对有气体物质的反应,为什么?);催化剂能改变化学反应速率。
[练习]
19.
在一定条件下N2 + 3H2 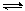 2NH3 的反应中,起始C(N2) 为2mol/L,C(H2)为5mol/L,
反应到2分钟时,测得 C(NH3 )为0.4mol/L,(1)分别用N2 、 H2、 NH3 表示反应速率。
2NH3 的反应中,起始C(N2) 为2mol/L,C(H2)为5mol/L,
反应到2分钟时,测得 C(NH3 )为0.4mol/L,(1)分别用N2 、 H2、 NH3 表示反应速率。
(2)反应到2分钟时C(N2) 为_________, C(H2)_________。
18. 某一反应物的浓度是2摩尔/升,经过两分钟的反应,它的浓度变成了1.6摩尔/升,求该反应的反应速率。
1、化学反应速率
 用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
用单位时间内反应物浓度的减小或生成物浓度的增加来表示。
计算公式为=△C / △t 时间:(如每秒、每分、每小时)
反应速率的单位:mol/(L•s ) mol/(L•min) mol/(L•h)
(1) 现表示的化学反应速率是平均速率,同一反应用不同物质表示的化学反应速率数值可能不同,必须注明物质。
(2)起始浓度不一定按比例,但是转化浓度一定按比例。
(3) 同一反应各物质的反应速率之比等于化学计量数之比。例:
2A(g)+3B
(g)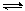 C(g)+4D(g)
ν(A):ν(B):ν(C):ν(D)
= 2 :3 :1 :4
C(g)+4D(g)
ν(A):ν(B):ν(C):ν(D)
= 2 :3 :1 :4
[练习]
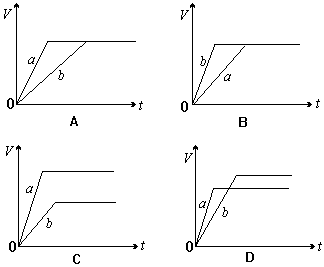
17. 等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是:( )
第三节 化学反应的速率和限度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com