
题目列表(包括答案和解析)
25.(8分)化学在自然资源开发和利用中具有十分重要的意义和作用,如对于金属矿物的冶炼就是其中一个重要方面。某研究性学习小组在实验室利用磁铁矿石(主要成份为Fe3O4)研究金属的冶炼。请你帮助计算或分析实验中存在的有关问题。
(1)计算:磁铁矿石中Fe3O4的质量分数为76.0%,SiO2的质量分数为11.0%,其余均为不含铁的易溶于水的杂质,若要冶炼出5g铁,需要这种矿石多少克?
(2)同学们称好所需质量的矿石后,老师建议他们在冶炼前,先除去矿石中的杂质,以提高矿石中有用成份的含量。请你帮他们设计一个简单的实验方案除去矿石中存在的杂质。

(3)实验室常用CO、H2等做还原剂来炼铁,同学们经过讨论后,决定采用H2做还原剂来炼铁,你认为他们不采用CO做还原剂的原因可能是什么?

(4)做好准备工作后,同学们开始用H2还原磁铁矿石。实验中发现反应速率比较慢。请你写出反应的化学方程式,并提出两项能加快该反应速率的措施。
24. (2分)2005年4月,各大媒体纷纷报道:根据美国最新研究,数十种牙膏、洗手液、洗洁精等抗菌清洁用品,当中包括高露洁等牌子的产品,含有三氯生(triclosan)的化学物质,该物质与经氯消毒的自来水接触后会产生“哥罗芳”,长期使用可致癌。已知三氯生中含碳的质量分数为49.75%,含氢的质量分数为2.42%,此外1个三氯生分子里含有2个氧原子和3个氯原子,且0.5mol三氯生的质量为144.75g,则
(1) 三氯生的相对分子质量为
(2) 三氯生的分子式为 。
23.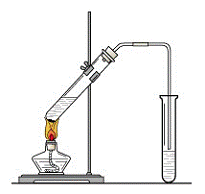 (12分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(12分) “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学反应方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:
。
(3)浓硫酸的作用是:① ;② 。
(4)饱和碳酸钠溶液的主要作用是
。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(7)做此实验时,有时还向盛乙酸和乙醇的试管里加入几块碎瓷片,其目的是 。
 (8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
(8)生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,也即达到化学平衡状态。下列描述能说明乙醇与乙酸的酯化反应已达到化学平衡状态的有(填序号) 。
①单位时间里,生成1mol乙酸乙酯,同时生成1mol水
②单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
③单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
 ④正反应的速率与逆反应的速率相等
④正反应的速率与逆反应的速率相等
⑤混合物中各物质的浓度不再变化
22. (8分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(8分)能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率。
(1)氢气在燃烧时,放出大量热量,说明该反应是 热反应,这是由于反应物的总能量 生成物的总能量;从化学反应的本质角度来看,是由于断裂反应物中的化学键吸收的总能量 形成产物的化学键放出的总能量。
 (2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势:
(2)氢气被公认为是21世纪代替矿物燃料的理想能源,5.2g氢气燃烧时放出286kJ热量,而每千克汽油燃烧时放出的热量为46000kJ。试据此分析氢气作为能源代替汽油的优势:
。
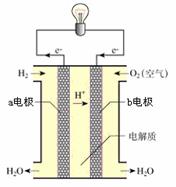
(3)通过氢气的燃烧反应,可以把氢气中蕴含的化学能转化为热能,如果将该氧化还原反应设计成原电池装置,就可以把氢气中蕴含的化学能转化为电能,右图就是能够实现该转化的装置,被称为氢氧燃料电池。该电池的正极是 (填a电极或b电极),在负极发生的电极反应是 ,电池反应为 。
21. (13分)乙烯和苯是来自石油和煤的两种重要化工原料,特别是乙烯,其产量是一个国家石油化工水平的标志。请回答:
(1) (5分)乙烯通入溴的四氯化碳溶液中,观察到的现象是 ;其反应方程式为 ;乙烯在一定条件下发生加聚反应的化学方程式为 。
(2) (3分)此外, 乙烯大量用来生产环氧乙烷,生产工艺主要有两种:
 工艺一:
工艺一:
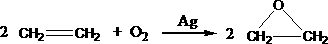 工艺二:
工艺二:
根据绿色化学的原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率为
;工艺二的原子利用率为 。因此,在实际生产中,应采用工艺 更环保、更经济。
(3) (5分)苯也是一种重要的化工原料,但人们对苯的认识经历了一个不断深化的过程。
苯的分子式为 。由于苯与同碳原子数的己烷相比,高度缺氢,人们认为它是一种不饱和烃,1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,其结构式为 ,称为凯库勒式,但后来大量实验事实和理论研究都表明,苯分子中6个碳原子之间的键是 。因此用凯库勒式表示苯的结构式是不确切的,只是沿用至今而已。苯能发生取代反应,请任写一个苯发生取代反应的化学方程式
20.
 (9分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(9分)物质结构和元素周期律是化学的重要理论知识,通过学习这部分知识,可以对所学元素化合物等知识从理论角度进一步加深理解。有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大, 已知A和B原子有相同的电子层数, 且A的L层电子数是K层电子数的两倍, C燃烧时呈现黄色火焰, C的单质在高温下与B的单质充分反应, 可以得到与D单质颜色相同的淡黄色固态化合物, 试根据以上叙述回答:
(1) (4分)元素名称: A ________ B __________ C __________ D ___________
(2) (1分)写出B元素在周期表中的位置,第_________周期,第_______族。
(3) (2分)AB2 的电子式为 ______________ ;C 单质在高温下与B单质充分反应所得化合物的电子式为 ___________________。
(4) (1分)用电子式表示化合物 C2D 的形成过程 _______________________________.
(5) (1分)一般情况下,B元素与氢元素形成的化合物是以____________键(填极性或非极性)结合的 化合物。
19.有X、Y两种元素,它们的原子序数都小于18,它们的离子属于下列哪种情况, 则X、Y必属于同一周期的元素
A. X、Y的离子具有相同的电子层结构 B. X-比Y2-少一个电子层
C. X+ 和Y2-具有相同的电子层结构 D. X+ 比Y2-少一个电子层
18. 下列各组物质中,可用溴水溶液来鉴别的是
A.甲烷与乙烷 B.乙烯与丙烯
C.苯与己烷 D.苯与溴苯
17. 自然界为人类提供了多种多样的营养物质,下列有关营养物质的说法正确的是
A.食用纤维素、淀粉、蛋白质、脂肪和植物油都是高分子化合物
B.棉花和蚕丝的主要成份都是纤维素
C.蔗糖、淀粉、油脂等都可以发生水解反应
D.油脂都不能使溴水褪色
16. 同分异构现象是造成有机物种类繁多的重要原因之一。下列物质不是1-戊烯(CH2=CH-CH2-CH2-CH3)的同分异构体的是:
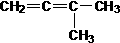 A .CH3-CH=CH-CH2-CH3 B.
A .CH3-CH=CH-CH2-CH3 B.
C.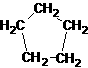 D.
D.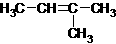
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com