
题目列表(包括答案和解析)
4.常见的大气污染物分为一次污染物和二次污染物,二次污染物是排入环境的一次污染物在 物理化学因素或微生物作用下发生变化所生成的新污染物,如2NO+O2=2NO2,则NO2 为二次污染物,下列四种气体①SO2,②NO,③NO2,④Cl2中能导致二次污染的是( )
A.仅①②③ B.仅②④ C.仅② D.①②③④
3.制备某种气体,下列方法中可行的是( )
①NaHSO4固体与MnCl2固体混合共热制HCl ②FeS与稀硝酸混合制H2S ③浓H2SO4与K2SO3固体混合制SO2 ④强热氯化铵固体制取氨气
A.①② B.②④ C.①③ D.①②③④
2.下列物质中,可用于治疗胃酸过多的是( )
A.氢氧化铝 B.碳酸钠
C.氧化钙 D.碳酸钡
1.食用下列物质不会引起中毒的是( )
A.用碳酸钡作X射线透视的“钡餐” B.加碘食盐
C.用甲醇兑制的白酒 D.用于混凝土防冻的亚硝酸钠
26.(8分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
25.(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式 。
(2)若将(1)中的反应设计成原电池,请画出原电池的装置图(标出正、负极) ,并写出电极反应式。正极反应 ,负极反应 。
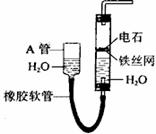 (3)实验室可用块状固体电石(主要成分CaC2)在常温下与水反应制取乙炔,可用右图实验装置。制取乙炔的化学方程式是
。图中,A管的作用是
。
(3)实验室可用块状固体电石(主要成分CaC2)在常温下与水反应制取乙炔,可用右图实验装置。制取乙炔的化学方程式是
。图中,A管的作用是
。
24.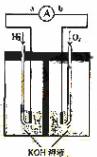 (9分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。
(9分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。
下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,
性质稳定,请回答:
 (1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为  (用a、b 表示)。
(用a、b 表示)。
 (2)负极反应式为 。
(2)负极反应式为 。
 (3)电极表面镀铂粉的原因为
。
(3)电极表面镀铂粉的原因为
。
23.(12分)一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如右图,依图所示:
(1)该反应的化学方程式是_____________________。
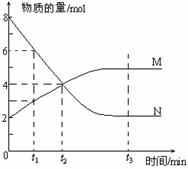 (2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(2)在图上所示的三个时刻中, (填t1、t2或t3)时刻处于平衡状态,此时V正 V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= 。
(3)若反应容器的容积不变,则“压强不再改变” (填“能”或“不能”)作为该反应已达到平衡状态的判断依据。
(4)已知M、N均为气体,则下列措施能增大反应速率的是 (选填字母)
A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
(5)向一个容积为4L的密闭容器中充入7molSO2和4molO2,在一定温度和压强下,发生如下反应:2SO2(g)+O2 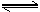
 2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为
;平衡时SO3的物质的量浓度 。
2SO3(g),经4 s后达到平衡状态,测得SO2的物质的量是3mol,则以O2表示的反应速率为
;平衡时SO3的物质的量浓度 。
22.(9分)

某学生用右图所示装置证明溴和苯的反应是取代反应而不是加成反应。主要实验步骤如下:
⑴ 检查气密性,然后向烧瓶中加入一定量的苯和液溴。
⑵ 向锥形瓶中加入某溶液适量,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下。
⑶ 将A装置中的纯铁丝小心向下插入混合液中。
请填写下列空白:
① 装置B的锥形瓶中小试管内CCl4的作用是 _;小试管外的液体是(填名称)___________,其作用是__ _________。
②反应后,向锥形瓶中滴加(填化学式)___________溶液,现象是___________,其作用是___________;装置(Ⅱ)还可起到的作用是_________
21. 钢铁生锈过程发生如下反应:
 ①2Fe+O2+2H2O=2Fe(OH)2;
①2Fe+O2+2H2O=2Fe(OH)2;
 ②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
②4Fe(OH)2+O2+2H2O=4Fe(OH)3;
 ③2Fe(OH)3=Fe2O3+3H2O。
③2Fe(OH)3=Fe2O3+3H2O。
 下列说法正确的是
下列说法正确的是
 A.反应①、②中电子转移数目相等
A.反应①、②中电子转移数目相等
 B.反应①中氧化剂是氧气和水
B.反应①中氧化剂是氧气和水
 C.与铜质水龙头连接处的钢质水管不易发生腐蚀
C.与铜质水龙头连接处的钢质水管不易发生腐蚀
 D.钢铁在潮湿的空气中不能发生电化学腐蚀
D.钢铁在潮湿的空气中不能发生电化学腐蚀
第Ⅱ卷(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com