
题目列表(包括答案和解析)
12.25℃时,若体积为Va、PH=a的某一元强酸与体积为Vb、PH=b的某一元强碱混合,恰好中和,且已知Va〈Vb和a=0.5b。填写下列空白。
(1)a值可否等于3(填“可”或“否”),其理由是 。
(2) a值可否等于5(填“可”或“否”),其理由是
(3) a的取值范围
11.在25℃时,有pH=a的盐酸与pH=b的NaOH溶液,取VaL该盐酸同该NaOH溶液恰好反应,需VbLNaOH溶液,问:
(1)若a+b=14时,则Va/Vb= (填数值);
(2)若a+b=13时,则Va/Vb= (填数值);
(3)若a+b>14时,则Va/Vb= (填表达式),
且Va Vb(填>、<或=)。
|
c值范围 |
被氧化的离子符号 |
被氧化离子的物质的量/mol |
|
0<c≤a |
|
|
|
a<c≤(3a+b)/2 |
|
|
|
(3a+b)/2<c≤3(a+b)/2 |
|
|
13.向含amolFeI2和bmolFeBr2的混合液中逐渐通人cmolCl2,试分别填写不同c值范围内被氧化的离子及其物质的量。
12. 已知铜在常温下能被HNO3 溶解。反应方程式为:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ +4H2O
(1)请将上述反应改成离子方程式________________________。
 (2)上述反应中,氧化剂是____________,氧化产物是_____________。HNO3 没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的___________.
(2)上述反应中,氧化剂是____________,氧化产物是_____________。HNO3 没有全部参加氧化还原反应,没有参加氧化还原反应的硝酸占参加反应的全部硝酸的___________.
11.已知:2Fe3+ + 2I- = 2Fe2+ + I2 2Fe2+ + Br2 = 2Fe3+ + 2Br-(不考虑氯气与I2的反应)
(1)含有1molFeI2和2molFeBr2的溶液中通入2molCl2,此时被氧化的离子是 ,
被氧化的离子的物质的量分别是 。反应的离子方程式为
。
(2)如果向含有1molFeI2和2molFeBr2的溶液中通入3molCl2,则被氧化的离子是 ,其对应的氧化产物的物质的量分别是 。反应的离子方程式为
。
(3)若向含有amolFeI2和bmolFeBr2的溶液中通入cmolCl2,当I-、Br-、Fe2+完全被氧化时,c为 (用含a、b的代数式表示)
13.取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00mol·L-1过量盐
酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100mol·L-1Ba(OH)2溶液得
到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mL·L-1盐酸恰好完全中和。计算
12. 已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。

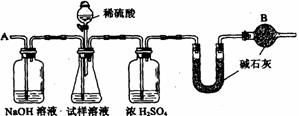
主要实验步骤如下:①按图组装仪器,并检查装置的气密性
 ②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
②将ag试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③称量盛有碱石灰的U型管的质量,得到bg
④从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤从导管A处缓缓鼓入一定量的空气
⑥再次称量盛有碱石灰的U型管的质量,得到cg
⑦重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为dg
请填空和回答问题:
(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明
(2)装置中干燥管B的作用是
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果 (填高、偏低或不变)
(4)步骤⑤的目的是
(5)步骤⑦的目的是
(6)该试样中纯碱的质量分数的计算式为
(7)还可以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。
11. 将n mol木炭粉和1 mol FeO在反应器中混合,隔绝空气加强热。
(1)可能发生的化学反应有:
①FeO+C===Fe+CO↑
②2FeO+C===2Fe+CO2↑
③FeO+CO===Fe+CO2↑
④
(2)若n<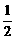 ,充分反应后,反应器中的固体物质是
,气体产物是
。
,充分反应后,反应器中的固体物质是
,气体产物是
。
(3)若n>1,充分反应后,反应器中的固体物质是 ,气体产物是 。
(4)若反应的气体产物是混合物,n的取值范围是 。
(5)若反应的气体产物是混合物,且混合物中CO和CO2的物质的量相等,则n的值为 。
13. 将20 mL充满NO和NO2的混合气体的试管倒立于盛满水的水槽中,充分反应后,剩余气体体积为10 mL,求混合气体中NO和NO2各占多少毫升?
将20 mL充满NO和NO2的混合气体的试管倒立于盛满水的水槽中,充分反应后,剩余气体体积为10 mL,求混合气体中NO和NO2各占多少毫升?
12. 某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将
某学习小组探究浓、稀硝酸氧化性的相对强弱的,按下图装置进行试验(夹持仪器已略去)。实验表明浓硝酸能将 氧化成
氧化成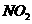 ,而稀硝酸不能氧化
,而稀硝酸不能氧化 。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
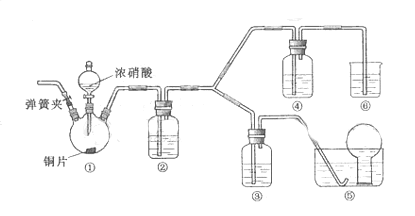
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与 反应,能与
反应,能与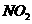 反应
反应
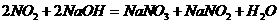
(1) 实验应避免有害气体排放到空气中,装置③、④、⑥中乘放的药品依次是
(2) 滴加浓硝酸之前的操作时检验装置的气密性,加入药品,打开弹簧夹后
(3) 装置①中发生反应的化学方程式是
(4) 装置②的作用是 ,发生反应的化学方程式是
(5) 该小组得出的结论依据的试验现象是
(6) 试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别涉及了一下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
a. 加热该绿色溶液,观察颜色变化
b. 加水稀释绿色溶液,观察颜色变化
c. 向该绿色溶液中通入氮气,观察颜色变化
d.
 向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
向饱和硝酸铜溶液中通入浓硝酸与铜反映产生的气体,观察颜色变化
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com