
题目列表(包括答案和解析)
3.已知:298K时,2SO2(g) + O2(g) 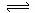 2SO3(g);△H = -Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
2SO3(g);△H = -Q1 KJ/mol,在相同温度下,向密闭容器中通入2molSO2和1molO2,达到平衡时放出热量Q2KJ,则下列关系式正确的是
A.Q1>Q2 B.Q1<Q2 C.Q1=Q2 D.无法比较
2.下列说法不正确的是
A.任何化学反应都伴随有能量变化
B.化学反应中的能量变化都表现为热量的变化
C.反应物的总能量高于生成物的总能量时,发生放热反应
D.反应物的总能量低于生成物的总能量时,发生吸热反应
1.下列反应既属于氧化还原反应,又属于吸热反应的是
A.铝片和稀盐酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应 D.甲烷在氧气中的燃烧
22.(10分) 实验:氧化铜的制备
在试管中倒入2mLCuSO4溶液,再加入一定量的氢氧化钠溶液,得到浅绿色的沉淀,将此浊液加热直至沸腾,无明显现象。继续滴加适量NaOH,沉淀逐渐变蓝,再加热沸腾,沉淀逐渐变黑。小明通过查找资料得知,该浅绿色沉淀物可能是碱式硫酸铜,其化学式为Cu2(OH)2SO4。
(1)请写出生成浅绿色沉淀的化学反应方程式 。
(2)请设计-个实验,证明该浅绿色沉淀中含有硫酸根离子
。
(3)写出浅绿色沉淀生成蓝色沉淀的化学反应方程式
,沉淀变蓝的原因是 。
(4)请写出蓝色沉淀转化为黑色沉淀的化学反应方程式
21.(10分) 某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。
 (1)滴定:①用 式滴定管盛装ca mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积
25.10mL(填大于、小于或者等于)。
(1)滴定:①用 式滴定管盛装ca mol/L盐酸标准液。右图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入③表空格中。滴定管中剩余液体的体积
25.10mL(填大于、小于或者等于)。
②下表是3种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
酚酞 |
|
变色范围(pH) |
5.0-8.0 |
3.1-4.4 |
8.2-10.0 |
该实验可选用 作指示剂;
③有关数据记录如下:
|
滴定序号 |
待测液体积(mL) |
所消耗盐酸标准液的体积(mL) |
||
|
滴定前 |
滴定后 |
消耗的体积 |
||
|
1 |
V |
0.50 |
25.12 |
24.62 |
|
2 |
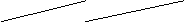 V V |
|
|
|
|
3 |
V |
6.00 |
30.58 |
24.58 |
(2)根据所给数据,写出计算烧碱样品的物质的量浓度的表达式(不必化简)
cb= 。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果 ;
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果 ;
d.若未充分振荡,刚看到溶液变色,立刻停止滴定,则会使测定结果 。
20.(8分)向明矾溶液中逐滴滴加Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH 7(填>、<、=),离子反应总方程式为 。
向明矾溶液中逐滴加Ba(OH)2溶液至铝离子刚好沉淀完全时,溶液的pH 7 (填>、<、=),离子反应总方程式为 。
19.(10分) 有下列六种物质:①氨水 ②硝酸铵 ③氯化钠 ④硫酸氢钾 ⑤次氯酸钠 ⑥碳酸氢钾
(1)能促进水电离的是 ;能抑制水电离的是 。
(2)能水解的是 ;水解的离子方程式是(任写一个) -。
(3)常温下,0.1 mol·L-1上述物质溶液pH由小到大的排列顺序是 。
18.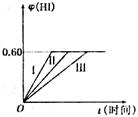 (8分) 将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g)
(8分) 将1 mol I2(g)和2 mol H2置于某2 L密闭容器中,在一定温度下发生反应:I2(g)+H2(g) 2HI(g);DH<0.并达到平衡。HI的体积分数j(HI)随时间t变化如图曲线(II)所示.
2HI(g);DH<0.并达到平衡。HI的体积分数j(HI)随时间t变化如图曲线(II)所示.
(1)平衡时,I2(g)的物质的量浓度为 mo1/L
(2)若改变反应条件。在甲条件下j(HI)的变化如图曲线(I)所示,在乙条件下j(HI)的变化如图曲线(III)所示.则
甲条件可能是 。乙条件可能是 (填入下列条件的序号)
①恒容条件下,升高温度 ②恒容条件下,降低温度
③恒温条件下.缩小反应容器体积 ④恒温条件下,扩大反应容器体积
⑤恒温恒容条件下,加入适当催化剂
(3)若保持温度不变。在另一相同的2 L密闭容器中加入amol I2(g)、b mol H2(g)和c mol HI(g)(a、b、c均大于0)发生反应,达平衡时,HI的体积分数仍为0.60,则a、b、c的关系是 (用含有a、b、c的代数式表示)
17. (6分)已知化学反应N2+3H2
(6分)已知化学反应N2+3H2 2NH3的能量变化如图所示,
2NH3的能量变化如图所示,
(1)1mol N 和3mol H 生成1mol NH3(g)是
能量的过程(填“吸收”或“释放”)。
(2)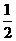 N2(g)+
N2(g)+ H2(g)
H2(g)  NH3(g ) △H=
;
NH3(g ) △H=
;
(3)N2(g)和H2生成NH3(1)的热化学方程式为
16.常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是
①二氧化硫水溶液 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
第Ⅱ卷 非选择题(共52分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com