
题目列表(包括答案和解析)
4.小明体检的血液化验单中,葡萄糖为5.9×10-3mol/L。表示该体检指标的物理量是
A.溶解度(s) B.物质的量浓度(c)
C.质量分数(w) D.摩尔质量(M)
3.下列说法正确的是
A、摩尔是物质的质量单位 B、氢气的摩尔质量是2g
C、1molOH-的质量是17g D、1mol气体所占的体积约为22.4L
2.悬浊液、乳浊液、溶液和胶体都是
A.稳定的液体 B.透明的液体 C.混合物 D.化合物
1.下列各物质的分类、名称(或俗名)、化学式都正确的是
A.碱性氧化物 氧化铁 FeO B.酸性氧化物 碳酸气 C0
C.酸 硫酸 H2S D.盐 纯碱 Na2CO3
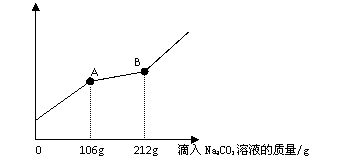
21.在一烧杯中盛有100gBaCl2和HCl
的混合溶液,向其中逐渐滴加溶质质
量分数为10%的Na2CO3溶液,混合溶
液的质量与所滴入Na2CO3溶液的质量关系曲线如图所示:
请根据题意回答问题(第(2)(3)小问应有必要的计算):
(1)在实验过程中,有气体放出,还可以看到的明显实验现象是 ____。
(2)在实验过程中放出气体的总质量为 g。
(3)当滴入Na2CO3溶液至图中B点时,通过计算求此所得不饱和溶液中溶质质量分数是多少?(计算结果精确到0.1%)
四川省南充高中09-10年高一上学期入学考试
18.(1)氨气(NH3)是一种无色有刺激性气味的气体,极易溶于水,其水溶液称为氨水,显碱性。实验室里通常用加热固体氯化铵和固体氢氧化钙的混合物的方法制取氨气,其化学方程式为:2NH4C1+Ca(OH)2 CaCl2+2NH3↑+2H2O。氨气在化工生产中应用广泛,如“侯氏制碱法”中就用到氨气。试回答下列问题:
CaCl2+2NH3↑+2H2O。氨气在化工生产中应用广泛,如“侯氏制碱法”中就用到氨气。试回答下列问题:
①实验室制氨气的发生装置与 相同(选择“A或B”填空)。
A.实验室用KMnO4制O2 B.实验室用大理石与稀盐酸制CO2
②收集氨气 用排水法收集(填“能或不能”)。
③“侯氏制碱法”中关键一步的反应原理可表示为:NH3+CO2+H2O+NaCl=NaHCO3+X。
X是一种氮肥,其化学式为 。
(2)某同学为制备纯净干燥的氢气,准备了下图所示的A、B、C三种装置。其中A装置最大的特点是可以随时使反应发生或停止。

①装置A中发生反应的化学方程式为____ 。
②关闭弹簧夹时,A内的反应随即停止是因为_ 。
③为制备纯净干燥的氢气,A、B、C三种装置的连接顺序为__________(填字母序号)。


17.某一由盐酸、碳酸钠溶液、稀硫酸、氯化铜溶液四种物质中的
两种混合形成的混合溶液,现向该混合溶液中滴入氢氧化钡溶液,产
生沉淀的质量与加人氢氧化钡溶液体积的关系如图所示。据此回答:
(1)该混合溶液是由 和 组成的。
(2)混合溶液中不含 ,理由是 ____________________。
混合溶液中也不含 ,理由是 ________________。
16. 实验结束时,同学们将含有
实验结束时,同学们将含有
CuSO4、ZnSO4、FeSO4的废液倒
在废液缸里,如果将废
液直接排放就会造成水
污染。于是几位同学利
用课余处理废液,回收
工业重要原料硫酸锌和有关金属。实验过程如图。请回答:
(1)滤液A和滤液B含有相同的溶质,其名称是 ;固体B的化学式为 。
(2)写出步骤①其中一个反应的化学方程式____ ;
步骤④发生反应的化学方程式为 。
(3)要检验步骤④中加入的稀硫酸是否足量的方法是 ___。
 (4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和
。
(4)若实验过程中的物质损失可以忽略,要计算该废液中硫酸锌的质量分数,必须称量:废液的质量和
。
15.通过一年的化学学习,我们认识了“酸”和“碱”,请回答下列问题:
(1)常见的酸有硫酸、盐酸等,在它们的水溶液里由于存在有相同的 离子(填符号),因此,它们有很多相似的化学性质,如: _________ 、
……等(写二条即可)。
 (2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥 __等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为:
。
(2)碱有氢氧化钠、氢氧化钙等,氢氧化钠可作某些气体的干燥剂,如:干燥 __等气体,氢氧化钙可由生石灰与水反应制得,化学方程式为:
。
(3)酸和碱能发生中和反应,它在日常生活和工农业生产中有广泛的应用,如硫酸厂的污水中含有硫酸等杂质,可用熟石灰进行处理,反应的化学方程式为: 。
(4)5·12汶川大地震灾害发生后,为了灾区人民群众的饮用水安全,卫生防疫部门要经常对灾区水源进行监测,获得可靠的科学依据。若现有一瓶水样,要获取它的酸碱度,应如何操作: 。
14.把等质量NaCl、SO3、Na2CO3·10H2O三种物质分别完全溶于等质量的水中,依次得到A、B、C三种溶液,它们的PH由大到小的顺序是(用A、B、C表示,下同)_________,这三种溶液的质量分数有大到小的是__________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com