
题目列表(包括答案和解析)
8.诗句“春蚕到死丝方尽,蜡炬成灰泪始干”中蕴含着很多化学含义。下列说法中不正确的是
A.诗句寓意着发生了化学变化
B.诗句中的“灰”指的是蜡烛燃烧产生的CO2等气体和炭粒
C.诗句中的“丝”含有的物质是纤维素
D.诗句中的“泪”指的是液态石蜡
7.下列是初中化学常见的几个实验操作,其中错误的是

A. 除去H2中CO2 B. 收集氧气 C. 稀释浓硫酸 D. 检查装置的气密性
6.中央电视台春节联欢晚会上,台湾魔术师刘谦以其匪夷所思的表演震撼了国人,他表演过程使用的道具中,属于无机非金属材料的是
A.玻璃杯 B.金戒指 C.化纤布料 D.橡皮筋
5. 元素周期表是学习化学的重要工具。右图是元素周期表中的一格,从中获取的信息错误的是
元素周期表是学习化学的重要工具。右图是元素周期表中的一格,从中获取的信息错误的是
A.该元素的原子序数为20
B.该元素属于非金属元素
C.该元素的原子核外有20个电子
D.该元素的相对原子质量为40.08
4.下图是水的微观层次结构,图中右侧“○”表示
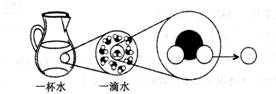
A.氢元素 B.氢原子 C.氧元素 D.氧原子
3.下列物质的用途与其化学性质无关的是
A.用熟石灰改变酸性土壤 B.用盐酸除去铁器表面的铁锈
C.焦炭用于冶炼金属 D.用铜丝做导线
2.实验室制氧气时,必须满足的首要条件是
A.必须用催化剂 B.必须用含氧物质作反应物
C.必须加热 D.必须用排水法收集
1.2009年起,泰州市中考采用网上阅卷。答题时我们要使用2B铅笔填涂答题卡。铅笔芯
的主要成分是
A.石墨 B.金刚石 C.二氧化锰 D.铅
29.
|
|
|
|
|
|
|
|

 石灰石 生石灰 熟石灰溶液
石灰石 生石灰 熟石灰溶液


|

 熔融MgCl2
Mg
熔融MgCl2
Mg
⑴从海水中提取食盐,是利用 和风力使水分蒸发,得到食盐。
⑵反应①的化学方程式是
⑶操作甲的名称是
⑷小李观察到老师每次拿镁条来做实验时,镁条表面总是有一层灰黑色的“外衣“,用砂布擦去才露出银白色的金属光泽。他请教老师后知道,这层“外衣”是镁条与空气中某些物质化合生成的一种化合物。他猜想,可能是MgO,也可能是Mg(OH)2 ,老师引导他分析,
该“外衣”不可能是MgO,原因是
⑸小李收集了一些干燥的该“外衣”,放入一个与空气、其他物质相隔绝的容器中加热,并将生成的气体依次通入装有干燥剂(只吸收水分,不产生新的气体)的干燥管和装有足量澄清石灰水的烧杯中。结果,干燥管质量增加,澄清石灰水变白色浑浊。
①该“外衣”不可能是Mg(OH)2, 原因是(不能只答实验现象)
②组成该“外衣”的所有元素的元素名符号是
③与镁反应生成该”外衣”的所有物质是
⑹假设镁条表面的“外衣”都是碱式碳酸镁(与碱式碳酸铜相似),现取该镁条6.22g,放入94.62g稀盐酸中,固体恰好完全溶解,产生0.44gCO2,求所得溶液的溶质质量分数。
2009-2010学年仪征金升外国语实验学校中考模拟
28.Fe(OH)3是一种红褐色沉淀,Fe(OH)2却是一种白色沉淀,它们都可以在水中通过发生复分解反应来制得。由于Fe(OH)2不稳定,在水中,只要有一点氧气就极易发生反应生成Fe(OH)3,写出其反应的化学方程式: ,因而在溶液中较难制得纯净的Fe(OH)2 。若按照常规方法向FeCl2溶液中滴加NaOH溶液,很难观察到白色沉淀现象,只能看到灰绿色沉淀。你认为此沉淀最可能的成分是 。
用下面两种精心设计的方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含氧气的蒸馏水配置FeSO4溶液与氢氧化钠溶液,然后反应制备。
⑴除去蒸馏水中溶解的氧气,常采用 的方法。
⑵先在试管中注入FeSO4溶液后,还要在试管中滴入 ,然后再考虑加入NaOH溶液,实验更容易获得成功。
 ⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。
⑶生成白色沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液,这样操作的理由是
。
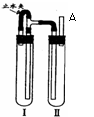
方法二:用右图装置来制备。
⑴在装置Ι中加入Fe和稀H2SO4 , ⑵在装置Ⅱ中加入NaOH浓溶液。
⑶为了制得白色Fe(OH)2沉淀,在装置Ι和Ⅱ中加入试剂,打开止水夹,塞紧橡胶塞,反应一段时间后再夹紧止水夹,在夹紧止水夹之前的实验步骤是 , 写出夹紧止水夹后Ⅱ中的反应方程式 、 。
⑷这样生成的Fe(OH)2沉淀能较长时间保持白色,其原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com