
题目列表(包括答案和解析)
25.(11分)(1) A___ __,B________,C________,D________,E________。
(2)________ 、________ 。
(3)__ ____ _ ________ 。
(4)_____ _ , ____ _。
24、(10分)(1)________________
(2)NH4Cl:_______________________; CO2:___________________。
H2O2:_______________________;NaOH:_______________________;
(3) ;
。
29、 W、X、Y和Z都是周期表中前20号元素,已知: ①W的阳离子和Y的阴离子具有相同的核外电子排布,且能形成组成为WY的化合物; ②Y和Z属同族元素,它们能形成两种常见化合物; ③X和Z属同一周期元素,它们能形成两种气态化合物; ④W和X能形成组成的WX2的化合物; ⑤X和Y不在同一周期,它们能形成组成为XY2的化合物。 请回答: (1)W元素是 ;X元素是 ;
Y元素是 ;Z元素是 。 (2)化合物WY和WX2的化学式分别是 和 。 (3)Y和Z形成的两种常见化合物的分子式是 和 。 (4)写出X和Z形成的一种气态化合物跟WZ反应的化学方程式:
莆田一中2008-2009学年下学期第二学段考试试卷答题纸
高一 化学必修2
28.(7分)将标准状况下2.24L乙烯和氢气的混合气体,在催化剂作用下充分反应,反应后的气体全部通入足量溴水中,制得3.76gCH2BrCH2Br(M=188),求原混合气体中乙烯和氢气的物质的量之比。
27.(8分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a,a是饱和NaCl溶液,X、Y都是惰性电极,通过导线与直流电源相连。实验开始时,同时在两极各滴入几滴酚酞试液,则
 (1)电解过程中反应的总化学方程式为________
;
(1)电解过程中反应的总化学方程式为________
;
X极附近观察到的现象是
(2)Y电极上的电极反应式为 _____ ______;
检验该电极反应产物的方法是 ____。
26.(18分)某有机物A,由C、H、O三种元素组成。已知B是石油化工发展水平的标志,是最简单的烯烃;在一定条件下由B可以转变为有机物A、C、D、E、F。转变关系如下:

(1)写出A、B、D、E的结构简式:
A B D E
(2)写出实现下列转化的化学方程式,并注明反应类型
D→E ______________________________________、 _ ____________
B→C _______________________________________、_________________
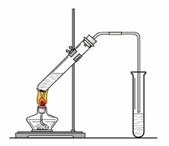 (3).在实验室我们也可以用如右图所示的装置制取F。回答下列问题:
(3).在实验室我们也可以用如右图所示的装置制取F。回答下列问题:
①浓硫酸的作用是:a ___ ;b ____________ 。
②右边的试管中装的是 ,其主要作用是___________ ________________________________ 。
③装置中通蒸气的导管不能插入溶液中,目的是_____________________________________。
④若要把制得的F分离出来,应采用的实验操作是 _。
25.(11分)A、B、C、D、E五种元素,它们的质子数依次递增,但都小于18。A元素原子核外只有1个电子。B元素原子和C元素原子最外层电子数之差为2。B元素原子L层上的电子数为K层电子数的2倍。B、C、D三种元素可以形成化学式为D2BC3的化合物,其焰色反应为黄色。0.5mol E元素的单质与足量的酸反应有9.03×1023个电子发生转移。在E和C的化合物中,E的质量占52.94%,又已知E的原子核中有14个中子。
(1)写出五种元素符号:
A___ __,B________,C________,D________,E________。
(2)画出D原子结构示意图、E阳离子结构示意图________ 、________。
(3)写出一个由上述元素形成的物质之间反应生成H2的化学方程式:
(4)五种元素中原子半径最大的是______,非金属性最强的是_____。
24、(10分)(1)油脂是一种重要的工业原料,请写出以硬脂酸甘油酯

为主要成分的油脂在碱性条件下发生皂化反应的化学方程式________________
(2)书写下列微粒的电子式:
NH4Cl:_______________________; CO2:___________________。
H2O2:_______________________;NaOH:_______________________;
(3)室温下,将2g苯(C6H6)完全燃烧生成液态水和CO2,放出83.6kJ的热量,写出C6H6燃烧的热化学方程式 。
若lg水蒸汽转化成溶液水放热2.44kJ,则室温下C6H6完全燃烧生成1mol水蒸气时所放出的热为 KJ。
23. 可逆反应: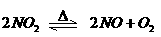 在密闭容器中反应,达到平衡状态的标志是
在密闭容器中反应,达到平衡状态的标志是
A、单位时间内生成 的同时消耗
的同时消耗
B、单位时间内生成 的同时,生成
的同时,生成
C、用 的物质的量浓度变化表示的反应速率的比为2:2:1的状态
的物质的量浓度变化表示的反应速率的比为2:2:1的状态
D、混合气体的颜色不再随时间改变的状态
22.反应4NH3(g) + 5O2(g) 4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
4NO(g)
+ 6H2O(g)在5L密闭容器中进行,半分钟后,NO的物质的量增加了0.3mol,则表示此反应的速率正确的是
A.v (O2)= 0.01mol·(L·s)–1 B.v (NO)= 0.008mol·(L·s)–1
C.v (H2O)= 0.003mol·(L·s)–1 D.v (NH3)= 0.02mol·(L·s)–1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com