
题目列表(包括答案和解析)
7.下列反应的离子方程式,不正确的是 ( )
A.氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+
BaSO4↓+2H2O
B.氧化铜和稀硫酸反应:CuO+2H+ Cu2++H2O
C.碳酸氢钠溶液和稀硫酸混合:HCO3-+H+ H2O+CO2↑
D.金属钠与水反应:Na+2H2O Na++2OH-+H2↑
6.用金属铜制取硝酸铜,从节约原料和防止环境污染考虑,最好的方法是:
A.铜 硝酸铜
B.铜
硝酸铜
B.铜 硝酸铜
硝酸铜
C.铜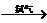 氯化铜
氯化铜 硝酸铜 D.铜
硝酸铜 D.铜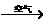 氧化铜
氧化铜 硝酸铜
硝酸铜
5.下列各组顺序的排列不正确的是 ( )
A.原子半径:Na<Mg<Cl B.热稳定性:HCl>H2S>PH3
C.酸性强弱:H2SiO3<H2CO3<H2SO4 D.碱性强弱:LiOH <NaOH
4、H218O和D216O分子中的中子数,前者和后者的关系是 ( )
A.大于 B.小于 C.等于 D.无法确定
3、对于 A ZX和A+1 ZX+ 两种粒子,下列叙述正确的是 ( )
A.质子数一定相同,质量数和中子数一定不同
B.化学性质几乎相同
C.一定都由质子、中子、电子构成
D.核电荷数,核外电子数一定相同
2、元素性质呈周期性变化的根本原因是 ( )
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
1.我国的“神州六号”载人飞船已发射成功,“嫦娥”探月工程已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的32He,每百吨32He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以42He的形式存在。下列说法正确的是 ( )
A.42He原子核内含有4个质子
B.32He和42He互为同位素
C.32He原子核内含有3个中子
D.42He的最外层电子数为2,所以42He具有较强的金属性
30.(15分)已知周期表中,元素Q、R、W、Y与元素X相邻,Y的最高价氧化物的水化物是强酸。回答下列问题:
(1)W与Q可以形成一种高温结构陶瓷材料。W的氯化物分子呈正四面体结构,W的氧化物的晶体类型是 ;
(2)与Q具有相同化合价且可以相互转变的氧化物是 ;
(3)R和Y形成的二元化合物中,R呈现最高化合价的化合物的化学式是 ;
(4)这5个元素的氢化物分子中,①立体结构类型相同的氢化物的沸点从高到低排列次序是(填化学式) ,其原因是
;
② 电子总数相同的氢化物的化学式和立体结构分别是 ;
;
(5)W和Q所形成的结构陶瓷材料合成方法如下:W的氯化物与Q的氢化物加热反应,生成化合物W(QH2)4和HCl气体;W(QH2)4在高温下分解生成Q的氢化物和该陶瓷材料。上述相关反应的化学方程式(各物质用化学式表示)是:
。
29.(5分)碳的稳定的氧化物除CO、CO2外,还有C3O2、C4O3、C5O2、C12O9等低氧化物,
其中C3O2是一种在常温下有恶臭的气体,其分子中的每个原子都满足最外层8电子结构。
(1)C3O2分子的电子式为 ,分子空间构型为 型;
(2)在C3O2、C4O3、C5O2、C12O9等碳的低氧化物中,若有分子空间构型与C3O2相同的,最可能是
28.(5分)用黄铁矿制取硫酸,再用硫酸制取化肥硫酸铵。锻烧含FeS280%的黄铁矿75t,生产出79.2t硫酸铵。若在制取硫酸铵时硫酸的利用率为90%,则用黄铁矿制取硫酸时FeS2的利用率是多少?
附加题(本题包括2小题,共20分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com