
题目列表(包括答案和解析)
1.水资源短缺是制约我国西北地区经济发展的主要因素之一,如在开发西北的过程中,为了满足经济发展的需要,大力开采地下水,必然会对当地的生态环境产生影响。在下列的有关分析中,你认为不正确的是
A.在不影响地下水资源平衡的条件下,开采适量的地下水用于灌溉,有利于农业生产的可持续发展
B.超量开采地下水,必然会造成地下水位的下降,使得当地的具有发达根系的旱生植物因根系够不着地下水而枯死,从而加速了荒漠的过程
C.地下水抽到地表用于灌溉,地表水再下沉到地下形成地下水,由于这种循环方式的存在,大力开采地下水资源不仅有利于农业生产的发展,对生态环境的改善也是有益的
D.利用基因工程,培育一些特别耐干旱的经济作物,对促进西北地区的农业经济的可持续发展是有利的
26.(11分)常温下,把CH4和O2组成的混合气体共a mol通入装有4.68 g Na2O2固体的密闭容器中,用电火花不断点燃,使之在高温下完全反应,恢复到常温时,容器内气压几乎为零。
(1)讨论剩余固体的成分与a的取值、CH4与O2的体积比值(n)三值的关系,填写下列表格。
剩余固体 a的取值
n=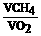 |
|
|
(2)当剩余固体全部加入足量盐酸中,产生560 mL气体(标准状况),剩余干燥的固体质量是多少?
25.(3分)把过量铁粉投入到由CuCl2和FeCl3组成的混合液中,充分搅拌反应后,过滤、干燥不溶物,称得其质量与加入铁的质量相等。求原混合液中CuCl2和FeCl3的物质的量浓度之比是多少?
24.(10分)如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步。

(1)如果将反应按加成、消去、取代反应分类,则A→F六个反应中(将字母代号填入下列横线上),属于取代反应的是 ;属于加成反应的是 ;属于消去反应的是 。
(2)中间体(Ⅰ)属于有机物的 类。
(3)如果将原料C2H5OH中的氧原子用18O标记,则生成物乙酸乙酯中是否有18O?如果将原料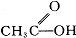 中羰基(
中羰基(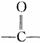 )或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否含有18O?试简述你作此判断的理由。
)或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否含有18O?试简述你作此判断的理由。
23.(8分)有一种名为菲那西汀的药物,其基本合成路线如下:
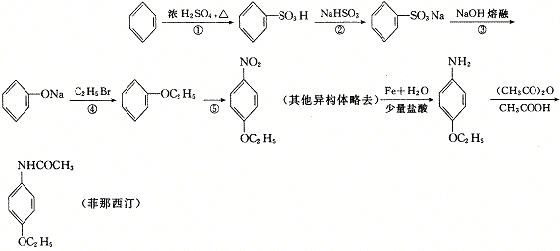 则:
则:
(1)反应②中生成的无机物化学式为 。
(2)反应③中生成的无机物化学式为 。
(3)反应⑤的化学方程式是 。
(4)菲那西汀水解的化学方程式为 。
|
|
|
③B+D====2KCl+MnO2+C↑
(1)写出A、B的化学式:A ;B
(2)第①步反应中,氧化产物是 ,被还原的元素是 。
(3)第③步反应的化学方程式为 。
22.(10分)在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如右图),容器中发生以下反应:N2+3H2 2NH3+Q,若反应达平衡后,测得混合气体为7体积。据此回答问题:
2NH3+Q,若反应达平衡后,测得混合气体为7体积。据此回答问题:

图5-3
(1)若保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果应达到平衡后混合气体中各物质的份数仍与上述平衡时完全相同,那么:①a=1,c=2,则b= ,在此情况下,反应起始向方向进行。(填“正”或“逆”)②若需规定反应起始时向逆方向进行,则c的取值范围是。
(2)在上述装置,若需控制平衡后的混合气体为6.5体积,则可采取的措施是 ,原因是 。
20.(12分)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气。反应式为:NaNO2+NH4Cl====NaCl+N2↑+2H2O+Q,实验装置如下图所示,试回答:
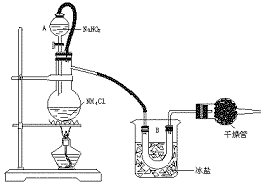
图5-2
(1)装置中A部的分液漏斗与蒸溜烧瓶之间连接的导管所起的作用是 。
A.防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气 C.使NaNO2饱和溶液容易滴下
(2)B部分的作用是 。
A.冷凝 B.冷却氮气 C.缓冲氮气流
(3)加热前必须进行的操作步骤是 。加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。
(4)收集N2前,必须进行的步骤是(用文字说明) 。
收集N2最适宜的方法是(填编号) 。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
19.(10分)如下图,已知A是常见的纯净气体,甲中黑色粉末为氧化铜或炭粉或两者的混合物。
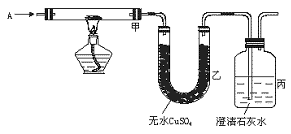
图5-1
(1)若A为CO2,在丙中可导出可燃性气体,则甲中反应的化学方程式为: 。
(2)若甲中黑色粉末为氧化铜,实验时甲处黑色变红色,乙处无变化,则A为 ,丙中的现象为 。
(3)若乙中白色粉末变蓝色,丙中出现白色浑浊物,则A为 ,黑色粉末为 。
18.一定温度下,将a mol PCl5通入一个容积不变的反应器中,达到如下平衡:
PCl5(g) PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入a mol PCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是:
PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入a mol PCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是:
A.2p1>p2 B.PCl5的分解率增大
C.2p1<p2 D.PCl3%(体积含量)减少
第Ⅱ卷(非选择题 共76分)
17.某溶液中有NH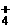 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH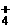 B.Mg2+ C.Fe2+ D.Al3+
B.Mg2+ C.Fe2+ D.Al3+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com