
题目列表(包括答案和解析)
7. 在下列化学反应中,既有离子键、共价键断裂,又有离子键、共价键形成的是
A.2Na +2H2O = 2NaOH + H2↑
B.SO2+2H2S = 3S+2H2O
C.Mg3N2+6H2O=3Mg(OH)2↓+2NH3↑
D.Ba(OH)2·8H2O+2NH4Cl==BaCl2+2NH3·H2O+6H2O
6. 下列物质分离过程中涉及共价键断裂的是
 A.用渗析法除去淀粉胶体中少量的NaCl
A.用渗析法除去淀粉胶体中少量的NaCl
 B.用饱和食盐水洗去Cl2中少量的HCl
B.用饱和食盐水洗去Cl2中少量的HCl
 C.用CCl4萃取碘水中的碘
C.用CCl4萃取碘水中的碘
 D.用升华法除去NaCl中混有的少量碘
D.用升华法除去NaCl中混有的少量碘
5. 下列每组物质发生状态变化所克服的粒子间的相互作用力属于同种类型的是
A.食盐和蔗糖的熔化 B.钠和硫的熔化
C.碘和干冰的升华 D.二氧化硅和氧化钠的熔化
4. 下列叙述正确的是
A.原子晶体中,共价键的键能越大,熔沸点越高
B.分子晶体中,分子间作用力越大,该分子越稳定
C.分子晶体中,共价键的键能越大,熔沸点越高
D.离子晶体熔化时离子键未被破坏
3. 下列物质中,既有共价键又有分子间作用力的是
A.氧化镁 B.氦 C.铜 D.液氨
2. 下列各组物质中,化学键类型相同、晶体类型也相同的是
A、CaCl2和Na2O B、碘、氖 C、CO2和H2O D、CCl4和KCl
1. 有关晶体的下列说法中正确的是
A.晶体中分子间作用力越大,分子越稳定
B.原子晶体中共价键越强,熔点越高
C.冰熔化时水分子中共价键发生断裂
D.氯化钠熔化时离子键未被破坏
22、
 (8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2 ;
(8分)已知下列两个反应:①Fe+H2SO4(稀)====FeSO4+H2 ;
②Cu+2H2SO4(浓)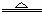 CuSO4+SO2 +2H2O。试回答下列问题:
CuSO4+SO2 +2H2O。试回答下列问题:
⑴反应①中 元素被还原,反应②中 元素被还原。(填元素符号)

 ⑵当反应①生成2g H2时,消耗H2SO4的质量是 g 。
⑵当反应①生成2g H2时,消耗H2SO4的质量是 g 。


 ⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是
g ,其中有 g H2SO4作为氧化剂被还原。
⑶反应②中生成32g SO2气体时,消耗H2SO4的质量是
g ,其中有 g H2SO4作为氧化剂被还原。
21、 (8分)现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲:
(8分)现有①KMnO4 ②H2 ③O2 ④CL2 ⑤CO ⑥AL 六种物质,从氧化性、还原性的角度分类,若将常用的氧化剂放入甲: 中,常用的还原剂放入乙:
中,常用的还原剂放入乙: 中,则:
中,则:
 ⑴甲中有 ;乙中有 。(填序号)
⑴甲中有 ;乙中有 。(填序号)


 ⑵由Fe
⑵由Fe  Fe3O4 ,Fe2O3
Fe3O4 ,Fe2O3 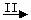 Fe 可知,欲实现I反应过程应从
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从
中找物质。
Fe 可知,欲实现I反应过程应从
(填“甲”或“乙”,下同)中找物质,欲实现II反应过程应从
中找物质。
 ⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。
⑶请将4种物质:Fe、Fe2O3、CO、CO2分别填入下面对应的横线上,组成一个配平了的化学方程式,并标出电子转移的方向和数目。



 +
=====
+
+
=====
+
⑷一氧化氮是工业制硝酸的中间产物,生成一氧化氮的化学方程式为:
4X+5O2 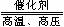 4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
4NO+6H2O,则根据质量守恒定律可以推出X的化学式为
。
20、



 (6分)已知H2O2中的氧元素呈现 -1价,H2O2分解(催化剂作用下)时可得到H2O和O2,表示该反应的化学方程式为
。根据氧化还原反应中的价态变化规律,推测H2O2在反应中:
(6分)已知H2O2中的氧元素呈现 -1价,H2O2分解(催化剂作用下)时可得到H2O和O2,表示该反应的化学方程式为
。根据氧化还原反应中的价态变化规律,推测H2O2在反应中:
⑴若作还原剂时,其被氧化后得到的产物是 。
 ⑵若作氧化剂时,其被还原后得到的产物是
。
⑵若作氧化剂时,其被还原后得到的产物是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com