
题目列表(包括答案和解析)
1、下图为一张已部分缺损的体检报告单,其中表示第14项高密度脂蛋白胆固醇的物理量是
35-55
g/L 20-30
15.2.43 mol/L
解:因为化学方程式中A.B.C的系数都为1,所以用A.B.C表示的反应速率都相同。根据题意,
温度升高了50℃,反应速率增大为原来的35倍,即平均反应速率增大为0.001 mol/(L·s)×35=0.243
mol/(L·s)。反应进行10秒后,C的浓度为0.243 mol/(L·s)×10s=2.43 mol/L。
14.(1)CH4+2O2 CO2+2H2O;
CO2+2H2O;
(2)负极;O2+2H2O+4e-=4OH-
(3)减小
(4)大于
解析:电极反应CH4+10OH--8e-=CO32-+7H2O,失去电子发生氧化反应,应该是电池的负极。因为两
个电极反应式合并则得到电池的总反应式,所以反过来用总反应式(写成离子方程式为
CH4+2O2+2OH-=CO32-+3H2O)与其中一个电极反应式左右两边分别相减则可以得到另一个电极
的反应式,也就是:
CH4+2O2+2OH- = CO32-+3H2O
-) CH4+10OH--8e- = CO32-+7H2O
2O2 - 8OH-+8e- = -4H2O
整理得电池的正极反应式为O2+2H2O+4e-=4OH-。
13.放出;46kJ
 解析:1mol H2中有1molH-H键,1molN2中有1mol N≡N,1molNH3中有3molN-H键,根据化学方程式N2+3H2
解析:1mol H2中有1molH-H键,1molN2中有1mol N≡N,1molNH3中有3molN-H键,根据化学方程式N2+3H2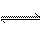 2NH3,要生成2molNH3,需要断裂1mol N≡N、3molH-H键,总共吸收热量:946k J+436kJ×3=2254kJ;同时要形成6molN-H键,总共放出热量:391k
J×6=2346k J。吸收的热量小于放出的热量,所以该反应是一个放出热量的反应,两者之间的差值为:2346k J-2254kJ=92kJ,即每生成1molNH3放出热量92kJ×1/2=46kJ。
2NH3,要生成2molNH3,需要断裂1mol N≡N、3molH-H键,总共吸收热量:946k J+436kJ×3=2254kJ;同时要形成6molN-H键,总共放出热量:391k
J×6=2346k J。吸收的热量小于放出的热量,所以该反应是一个放出热量的反应,两者之间的差值为:2346k J-2254kJ=92kJ,即每生成1molNH3放出热量92kJ×1/2=46kJ。
12.AB 把块状矿石碾成粉末增大了固体反应物的表面积、增大O2压强可以增大O2浓度都能加快
反应速率。硫铁矿燃烧本身有氧化铁产生,添加氧化铁对反应没有影响,降温和降低SO2的浓度
都不能提高反应速率。本题应选AB。
11.B
10.AD 铝和稀盐酸反应、氧化钙和水反应都使温度升高,是放热反应。
9.AC
8.A 空气应适当过量,但不是越多越好,因为空气越多带走燃烧产生的热量也越多,反而降低燃
料的利用效率。
7.A 加入盐酸中HCl的物质的量相等,反应时各溶液的体积都相等,因此决定反应速率快慢的是
X的物质的量,四个选项中X的物质的量最大的是A。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com