

题目列表(包括答案和解析)
7.将钠放置在空气中,是生成白色的Na2O还是淡黄色的Na2O2,主要取决于下列因素中的
A.反应温度 B.空气的量 C.钠粒的大小 D.钠的形状
6.在空气中铝制品比铁制品更不易被锈蚀,原因是
A.铝的金属活动性比铁弱 B.铝的密度比铁的密度小
C.铝在空气中易与氧气形成一层致密的氧化膜 D.铝不能与氧气发生反应
5.下列有关钠离子与钠原子的叙述中,正确的是
A.原子核内所含质子数目不同 B.钠离子中溶液中无色,而钠原子聚集呈银白色
C.钠离子在半径比钠原子半径大得多 D.钠离子与钠原子均具有较强的还原性
4.实验室中保存金属的方法是
A.放在水中 B.放在四氯化碳中 C.放在煤油中 D.放在细沙中
3.下列关于铝的叙述中,不正确的是
A.铝是地壳中含量最多的金属元素 B.常温下,铝能与NaCl溶液发生置换反应
C.铝是一种比较活泼的金属 D.在化学反应中,铝容易失去电子,是还原剂
2.下列性质中不是所有金属共有的是
A.易导热 B.有金属光泽 C.不透明 D.易与氧气反应
1.下列有关厨房中铝制品使用合理的是
A.盛放食醋 B.烧煮开水 C.用碱水洗涤 D.用金属丝擦洗表面的污垢
21.(8分)镁与一定浓度的稀硝酸反应时,硝酸的还原产物为NH4NO3。现将一定量的镁粉投入200 ml 稀硝酸中,两者恰好完全反应。若向反应后的溶液中加入过量的浓NaOH溶液并微热,溶液中有白色沉淀的生,同时有氨气逸出,且逸出的氨气全部被稀硫酸吸收,稀硫酸增重0.17g 。试回答下列问题:(已知:4Mg+10HNO3===4Mg(NO3)2+NH4NO3+3H2O)
(1)发生还原反应的硝酸的物质的量为________________mol。
(2)参加反应的镁的质量为___________________g。
(3)原稀硝酸的物质的量浓度为_________________________ mol·l-1。
20.(8分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解。该反应的化学方程式为:____________________________________。
(2)在一定体积的10 mol·l-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol。则浓硫酸的实际体积_________(填“大于”、“等于”或“小于”)100ml。若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
___________________________________________________________________________.
(3)根据下图操作及现象推断酸X为______________(填序号)。
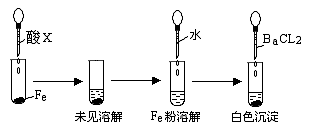
a、浓盐酸 b、浓硫酸 c、浓硝酸
19.(9分)已知X气体是一种无色有刺激性
气味的酸性氧化物,有关X、Y、Z、W的转化
关系如下,反应①-④均为化合反应。回答下列问题:
(1)Y的化学式为___________,
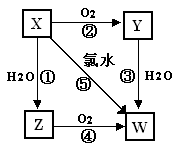 Z的化学式为____________。X直接排入空气中
Z的化学式为____________。X直接排入空气中
易造成的环境问题是_______________________。
(2)反应①-⑤中属于可逆反应的是
 ___________________,属于氧化还原反应的是
___________________,属于氧化还原反应的是
_______________________________________。
(3)写出反应⑤的化学方程式:_______________________________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com