
题目列表(包括答案和解析)
6.蛋白质分子的进化
比较不同生物体内执行相同生理功能的蛋白质分子的结构是确定生物之间亲缘关系的常用方式,被称为生物进化分子生物学方面的证据。如细胞色素C普遍存在于动植物的线粒体中,它是由104个氨基酸组成的一种呼吸色素,近年来,对不同物种的细胞色素C的氨基酸排列顺序进行了测定,其结果见下表
不同物种的细胞色素C中的氨基酸差异
|
生物名称 |
黑猩猩 |
猕猴 |
马 |
鸡 |
果蝇 |
小麦 |
酵母菌 |
红螺菌 |
|
与人类氨基酸差异数 |
0 |
1 |
12 |
13 |
27 |
35 |
44 |
65 |
这种在同一种蛋白质分子中氨基酸分子差异数越小,亲缘关系就越近,反之则越远。科学家估计,蛋白质分子的进化速度大约每2000万年蛋白质分子中有1%的氨基酸发生替换。从对细胞色素C的研究结果看出,人与黑猩猩的亲缘关系最近,从共同的祖先分化成两个物种的时间还不到2000万年,而人和黑猩猩与猴子发生分歧的时间大于2000万年。
5.蛋白质代谢
蛋白质代谢可用下图表示。
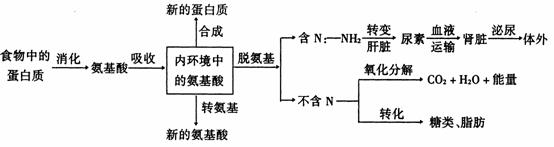
蛋白质代谢的过程:一般以内环境或血浆中的氨基酸为中心讲述蛋白质代谢的过程。
(1)体内氨基酸的代谢变化
①用来合成各种组织蛋白质。体内的氨基酸用来合成各种组织蛋白质是一条主要的代谢途径。如合成红细胞中的蛋白质、肌肉细胞中的肌球蛋白和肌动蛋白等。
②合成具有一定生理功能的蛋白质。在合成的新的蛋白质中,除了各处组织蛋白质外,还能合成各种具有一定生理功能的特殊蛋白质。如肝细胞能够合成血浆蛋白中的纤维蛋白原和凝血酶原等;消化腺上皮细胞能够合成消化酶;某些内分泌细胞能够合成蛋白质类激素,如垂体等;某些白细胞还能合成抗体。
③通过转氨基作用合成新的氨基酸。在人体内参与蛋白质构成的氨基酸共有20种,根据人体自己能否合成分为两类,一类是非必需氨基酸,这类氨基酸能够通过转氨基作用合成,合成时所需要的原料主要来自两个方面:一是糖代谢的中间产物,即葡萄糖在有氧呼吸过程产生的中间产物;二是体内必须要有多余的氨基酸提供氨源。转氨基作用即通过转氨酶的作用,将一种氨基酸上的氨基转移给糖代谢的中间产物,形成另一种新的氨基酸。如谷氨酸和丙酮酸在谷丙转氨酶的催化下,谷氨酸的氨基转移给丙酮酸,生成丙氨基和另一种酮酸(a-酮戊二酸)。另一类是必需氨基酸,这类氨基酸不能在人和动物细胞内合成,只能从食物中得到补充,必需氨基酸共有8种:赖氨酸、色氨酸、苯丙氨酸、亮氨酸、异亮氨酸、苏氨酸、甲硫氨酸和缬氨酸。
④通过脱氨基作用分解氨基酸。在人体内总有一部分氨基酸被彻底分解掉,分解氨基酸首先要通过脱氨基作用,将氨基酸分解成两个部分:含N和不含N部分。含N部分是氨基(-NH3,氨基很容易在体内形成NH3,NH3对人体是有毒的,但在肝脏中,在消耗ATP的情况下与CO2生成尿素,尿素的毒性比NH3要小得多,这是生物对环境的一种适应。肝脏中生成的尿素通过血液循环运输到肾脏,通过肾脏的泌尿过程形成尿液排出体外。不含N的部分是一条碳链,可以被彻底氧化分解成CO2和H2O,同时释放能量,也可以合成为糖类和脂肪。
(2)内环境中氨基酸的来源
①食物中的蛋白质经消化吸收后进入内环境。这是体内氨基酸来源中最主要的一条途径。
②体内蛋白质的分解。在动物和人体内,每天都要更新大量的蛋白质,这些被更新的蛋白质最初分解成氨基酸,这些氨基酸中的大部分被重新用来合成新的蛋白质,只有一小部分通过脱氨酸作用分解掉。所以体内被更新的蛋白质被分解成氨基酸,是内环境中氨基酸的另一个重要来源。
③合成一些非必需氨基酸。通过转氨基作用可以合成一些非必需氨基酸,也是内环境中氨基酸的一种来源。但这个过程不会使体内氨基酸的总数增加,因这个过程是合成一个新的氨基酸必须分解一个其它的氨基酸。但转氨基作用在人及动物体内具有非常重要的生理意义。在食物中的蛋白质中,各种氨基酸的比例不一定与人及动物体的需要相一致,某种氨基酸特别多一些,而另一种氨基酸却相对少一些,通过转氨基作用就可以将特别多的这种氨基酸的氨基转移到另一种化合物上合成一种相对少一些的氨基酸,使人及动物体尽可能地提高对食物中蛋白质的利用率。
4.蛋白质分子的功能
蛋白质分子结构具有多样性就决定了蛋白质分子具有多种重要的生理功能,在高中生物教材上将其归纳为2点:一是有些蛋白质分子是构成细胞和生物体的重要物质,如人和动物肌肉中的蛋白质,输送氧气的血红蛋白等;二是有些蛋白质是调节细胞和生物体的新陈代谢作用的重要物质,如调节生命活动的许多激素是蛋白质,催化新陈代谢各种化学反应的酶是蛋白质等。对教材进行综合分析后,可以总结出蛋白质的功能有下列五点:①组成细胞的结构成分,如细胞膜中的蛋白质,染色体中的蛋白质,肌肉细胞中的蛋白质,红细
胞中的血红蛋白等;②运输功能,如细胞膜上的载体蛋白、运输氧气的血红蛋白等;③催化功能,如催化各种生化反应的酶等;④调节功能,如生长激素、胰岛素等激素;⑤免疫功能如B淋巴细胞受到抗原刺激后产生的抗体是蛋白质,具有与特异性的抗原结合,从而达到清除抗原的目的。
酶是蛋白质,也是催化剂。酶作为催化剂具有一般无机催化剂所具有的一切特点,如只改变反应速度,不改变反应平衡,能够降低反应物的活化能,促进反应的进行,但自身不被消耗掉等。酶是生物催化剂,除了具有一般的无机催化剂的特点外,还具有生物催化剂所特有的特点,如专一性、高效性、多样性和易受pH值和温度的影响。
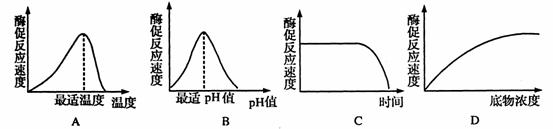
酶的专一性是指一种酶只能催化一种物质或同一类物质的化学反应。酶促反应的专一性与酶是蛋白质的结构有关,每种蛋白质都有特定的空间结构,酶催化反应时,酶蛋白分子首先与底物分子结合,但酶分子与底物分子能否结合,取决于酶分子的活性部位与底物分子在空间构象上是否对应,如下图。蛋自质分子结构具有多样性,所以酶也具有多样性,在生物体内存在着许许多多酶,催化着生物体内各种各样的生物化学反应,所以酶具有多样性的特点。

酶-底物相互作用的“钥匙与锁”模型
影响酶促反应的因素主要是温度和pH值。酶是蛋白质,蛋白质的分子结构和功能状态要受温度和pH值的影响。温度对酶的影响是:在较低温度时,随着温度的升高,酶的活性也逐渐提高,达到最适温度时,酶的催化能力最高,但高于最适温度后酶的催化能力会迅速下降,最后完全失去催化能力,其原因是低温不破坏蛋白质的分子结构,高温会导致蛋白质分子发生热变性,而蛋白质的变性是不可逆的,如下图A所示,所以在最适温度两侧的曲线是不对称的。pH值对酶的影响是:酶的催化能力的发挥有一个最适pH值,在低于最适pH值时,随着pH值的升高,酶的催化能力也相应升高,高于最适pH值时,随着pH值的升高,酶的活性逐渐下降,在最适pH值两侧的曲线基本是对称的,如下图B。酶的催化能力与时间也有关系:即使在最适温度和pH值的条件下,酶的催化能力也不是一成不变的,酶在“工作”了一段时间后会发生钝化现象,即催化能力开始下降,最后失去催化能力,因为任何蛋白质分子都有一定的寿命,如下图C。这些严重钝化或失去催化能力的酶在细胞中水解酶的作用下会被分解成氨基酸,氨基酸可以再度合成蛋白质。酶促反应的速度与底物的浓度也有关系:在酶量一定的条件下,在一定范围内会随着底物浓度的增加,反应速度也增加,但底物达到一定浓度后也就不再增加了,原因是酶饱和了,如下图D曲线所示。
有些酶纯粹是由蛋白质构成的,称为单酶,如胃蛋白酶。有些酶除蛋白质外还含有非蛋白部分,或者还需要一些其他物质的参与才能发挥作用,这样的酶称为复酶,其中非蛋白部分称为辅助因子。辅助因子有一些是简单的离子,如:Cl-是唾液淀粉酶的辅助因子;Mg2+是参与葡萄糖降解的一些酶的辅助因子;Fe2+是氧化物酶的辅助因子;Cu2+是细胞色素酶等的辅助因子等。有些离子与底物和酶结合起来使酶分子的构象稳定,从而保持其活性;有些离子是酶促反应的作用中心。有些辅助因子是有机化合物,特称为辅酶,如B族维生素就是一种羧化酶的辅酶等。
3.蛋白质分子的生物合成及其代谢
在细胞及生物体内,蛋白质的合成是在DNA(基因)的控制之下,必须经过转录和翻译才能完成。转录的场所一般是在细胞核中进行(线粒体和叶绿体中也有转录过程,原核生物无核,只能在细胞质中进行),转录的过程是:基因中的一段DNA分子首先解旋,然后按照碱基互补配对原则,以其中的一条链为模板合成RNA,这样遗传信息就转换成遗传密码,带有遗传密码的RNA称为mRNA。翻译是在细胞质的核糖体上进行的,mRNA转录完成后通过核孔进人细胞质中与核糖体结合。核糖体与mRNA结合的第一个位点是AUG,这是起始密码。然后tRNA携带特定的氨基酸,其一端的3个碱基与mRNA对应的碱基配对。mRNA上3个相邻的碱基决定一个氨基酸,这3个相邻的碱基称为密码子。与mRNA上AUG配对的tRNA运载的氨基酸是甲硫氨酸,接着各种tRNA携带着特定的氨基酸依次与mRNA上对应的密码子配对。在核糖体上相邻的tRNA携带的氨基酸,在相关酶的催化下缩合形成肽键,同时产生一分子水。当翻译到一定的时候,mRNA上出现 UAG、UAA、AGA时,由于这 3组碱基没有与之对应的 tRNA配对,翻译到此结束,所以这 3组碱基组合称为终止密码。按照基因控制蛋白质的合成过程,任何一个蛋白质分子的多肽键上的第一个氨基酸都是甲硫氨酸,但事实并非如此。原因是翻译成的多肽链是一个初级产品,还要经过一定的修饰,加工才能成为能够执行一定生理功能的蛋白质。在绝大部分的蛋白质分子中,肽链上的第一个氨基酸不是甲硫氨酸,因这个氨基酸在蛋白质分子的修饰加工过程中被修饰掉了。
在人体内蛋白质的代谢是以氨基酸为中心进行的。内环境中的氨基酸的来源主要有3条:一是消化吸收来的;二是通过转氨基作用从糖类转变而来的;三是体内蛋白质分解。内环境中的氨基酸的代谢去向主要也有3个:一是合成新的蛋白质;二是通过转氨基作用转变成其他的氨基酸;三是经脱氨基作用分解。在蛋白质代谢过程中,氨基酸经脱氨基作用形成的含N部分是NH3,NH3对人体是有毒的,但在肝脏中通过肝脏的解毒作用转变成尿素,尿素基本对人体无害,再通过循环系统运至肾脏,以尿液的形式排出体外,或运至皮肤的汗腺以汗液的形式排出体外。
物质代谢包括糖类代谢、蛋白质代谢和脂肪的代谢。这三类营养物质的代谢枢纽是呼吸作用,主要是通过呼吸作用的中间产物,如丙酮酸、乙酰辅酶A、柠檬酸等中间产物。糖类转变成蛋白质必须通过转氨基作用,将氨基转移给糖代谢的中间产物就能产生新的氨基酸,如将氨基转给丙酮酸即为丙氨酸,在人体能够合成的氨基酸称为非必需氨基酸,共有12种,还有8种在人体内不能合成,必须从食物中得到的氨基酸称为必需氨基酸,如赖氨酸、色氨酸等。蛋白质转变成糖类必须经过脱氨基作用,形成的不含氮部分才能转变成糖类。糖类转变成脂肪必须通过乙酰辅酶A,脂肪转变成乙酰辅酶A后才能进人呼吸作用,继而再转变成糖类和蛋白质。
2.蛋白质的分子结构及其性质
蛋白质分子是由许多氨基酸通过肽键连接起来的高分子化合物。缩合反应是指一个氨基酸的羧基与另一个氨基酸分子的氨基相连接,同时失去一分子水,形成一个肽键的反应。反应方程式是:
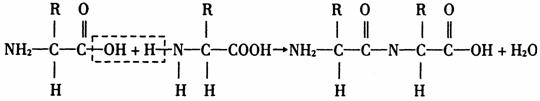
缩合反应在化学上称为缩聚反应,在细胞内进行的场所是核糖体,而且是在mRNA的指导下,有tRNA参与才能完成。多肽是由多个氨基酸分子缩合而成的含有多个肽键的化合物。肽链通过R基与R基之间的相互作用形成一定的空间结构。一个执行特殊生理功能的蛋白质可以是由一条肽链组成(如生长激素是由191个氨基酸组成的一条肽链),也可以是由多条肽链组成(如胰岛素是由51个氨基酸、2条肽链组成的,血红蛋白是由574个氨基酸、4条肽链组成的)。
蛋白质分子中肽键数目的计算:设氨基酸数目为n,肽链数为a,肽键数目为b。则b=n-a.
蛋白质分子结构的多样性主要从4个层次加以理解:一是构成蛋白质分子的氨基酸种类不同;二是组成每种蛋白质分子的氨基酸数目不同;三是氨基酸的排列顺序不同;四是由于前三项造成蛋白质分子的空间结构不同。蛋白质分子结构的多样性实际是由DNA分子结构的多样性决定的。
多肽是链状结构,一端游离着一个氨基,另一端游离着一个羧基,所以蛋白质分子也是两性化合物。
蛋白质分子的空间结构不是很稳定的,蛋白质在重金属盐(汞盐、银盐、铜盐)、酸、碱、乙醇、尿素、鞣酸等的存在下,或热至70℃-100℃,或在X射线、紫外线等射线的作用下,其空间结构发生改变和破坏,导致蛋白质变性,使蛋白质的生物活性丧失,如酶失去催化能力、血红蛋白失去输氧能力等。在发生的变性过程中不发生肽键的断裂和二硫键破坏,主要发生氢键、疏水键的破坏,使肽链的有序的卷曲、折叠状态变为松散无序。蛋白质变性后溶解度降低,失去结晶能力,并形成沉淀。蛋白质的变性具有不可逆性。
1.氨基酸的分子结构和性质
构成蛋白质的氨基酸都是2-氨基酸,通式是: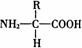
氨基酸分子的性质是氨基酸分子上的氨基(NH2-)和羧基(一COOH)决定的,氨基酸是两性化合物,氨基是碱性的,羧基是酸性的。构成蛋白质的氨基酸有20种,20种氨基酸的不同之处是R基的不同。即20种氨基酸就有20种不同的R基。如果R基上带有氨基,称为碱性氨基酸。
2.脂肪的代谢
食物中的脂肪在消化道内通过胆汁的乳化和脂肪酶的催化下分解成甘油和脂肪酸,经扩散的形式被小肠绒毛上皮细胞吸收后,在上皮细胞内再合成脂肪,与载脂蛋白结合后和类脂、胆固醇混合后一起进入毛细淋巴管,通过淋巴循环进入血液循环,最后输送到各部分组织。脂类物质进人生物体内后的代谢去向:一是参与构成动物体的组织,如磷脂是生物膜的组成成分;二是作为备用物质贮存在皮下、肠系膜、大网膜等处;三是在需要的情况下,可再分解甘油、脂肪酸等,然后直接分解为CO2和H2O,或者转化成肝糖元等;四是被各种腺体利用来生成各自的特殊分泌物,如皮脂腺分泌的皮脂、乳腺所生成的乳汁等、内分泌腺分泌的各种类固醇激素等。
1.脂类的元素组成、种类及功能
脂类的元素组成是C、H、O,有些脂类还含有少量的N和P。脂类的种类及功能见下表。
|
种 类 |
功 能 |
备 注 |
|
|
脂 肪 |
贮存能量,保温 |
贮备能源,贮存在皮下、肠系膜等处 |
|
|
类脂 |
主要是磷脂 |
是组成细胞膜的成分 |
神经组织、卵和大豆中含量较多 |
|
固醇类 |
胆固醇 |
是生物膜的组成成分之一,对维持膜的正常的流动性有重要作用 |
胆固醇在人体有一个正常含量,过高会导致血管硬化、高血压等 |
|
性激素 |
促进生殖胞的形成和生殖器官的发育,激发并维持第二性征 |
有雌性激素和雄性激素二类,雌性激素由卵巢分泌,雄性激素由睾丸分泌 |
|
|
维生素D |
促进小肠对钙和磷的吸收和利用VD可预防和治疗佝偻病、骨质蔬松症等 |
人的皮肤的表皮中有7-去氢胆固醇,在紫外线照射下,通过酶的作用可转化成VD |
3.动物体内的糖代谢及其调节
以哺乳动物为例,动物体内的糖代谢及其调节过程可归纳为下图。

哺乳动物体内的糖代谢是以血糖为中心展开的。血糖的来源:①食物中的淀粉通过消化道消化吸收来的,这是血糖来源的主要途径;②通过肝糖元分解成葡萄糖释放到血糖中形成血糖,这个过程一般发生在饥饿条件下;③蛋白质和脂肪的转化,蛋白质转化成血糖必须通过脱氨基实现,这个过程只有在糖类供应严重不足的情况下才会发生。血糖的主要代谢去向是:①血糖通过血糖循环运到各组织细胞,被彻底氧化分解成CO2和H2O,同时释放出能量供生命活动之需,这是血糖的主要代谢去向;②血糖可以转化成糖元,在肝脏中转化成肝糖元,肌肉组织中转化成肌糖元,肝糖元可以转化成血糖,但肌糖元不可以转化成血糖,而直接被肌细胞所氧化分解提供能量;③血糖可以转化成蛋白质和脂肪,血糖转化成蛋白质必须要有N源,即必须要有氨基,利用糖代谢中的中间产物通过转氨基作用合成新的氨基酸。
以哺乳动物为例,血糖的浓度稳定在0.1%(质量分数),换算成物质的量为 5.6mmol/L。参与血糖浓度调节的激素主要有两种:胰岛素和胰高血糖素。胰岛素是由胰岛中的B细胞分泌的,胰岛素是由含51个氨基酸的两条肽链构成的蛋白质,功能是:促进血糖合成糖元,促进血糖分解,总的效应是降低血糖浓度。胰高血糖素是由胰岛的A细胞分泌的,作用是:抑制糖元的合成,促进糖元分解,升高血糖浓度。当血糖浓度高于0.1%时,反馈性促进胰岛的B细胞分泌胰岛素,抑制A细胞分泌胰高血糖素,促进血糖转变成糖元或被分解,降低血糖浓度。当血糖浓度低于0.1%时,反馈性地抑制胰岛B细胞分泌胰岛素,促进A细胞分泌胰高血糖素,达到升高血糖的目的。如下图所示。
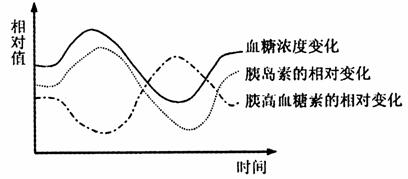
血糖浓度、胰岛素和胰高血糖素之间的相对变化关系
在人体内,血糖浓度必须保持相对的稳定,如果血糖浓度过低,人体各组织、器官的能源供应不足就会出现代谢障碍,极端的例子就是低血糖休克。低血糖导致休克的原因是:人体的神经组织,特别是脑和脊髓几乎不贮存糖类(能源物质),必须通过血液源源不断地提供给神经组织。血糖浓度过低,能源供应不足是导致低血糖休克的主要原因。对低血糖休克病人抢救治疗最有效的措施是注射葡萄糖注射液。如果血糖浓度过高,会导致人的尿液中含有葡萄糖,这是糖尿病人的典型症状。原因是:肾脏的肾小球对血糖过滤后形成原尿,原尿的成分与血浆是基本相同的,如果血糖浓度过高,原尿中的葡萄糖浓度也相应增高,当超过了肾小管对葡萄糖的重吸收能力后,就会有一部分葡萄糖未被吸收而进入尿液。由于尿液中有葡萄糖,使尿液的渗透压增高,会减少肾小管对水的重吸收,所以糖尿病人的症状之一是尿多。引起糖尿病的主要原因之一是胰岛合成和分泌胰岛素减少或停止分泌引起的。糖尿病是一种多基因遗传病,在一定的外界诱发因素作用下,就很容易发病。节制饮食是预防和控制糖尿病的有效措施。
2.糖类与光合作用和呼吸作用
植物进行光合作用的产物主要是葡萄糖,植物体内的物质代谢是以糖为基础进行的。叶绿体进行光合作用制造的葡萄糖可以合成蔗糖等二糖,运出叶绿体及叶肉细胞,为植物体的其他器官提供能源和原料;也可以在叶绿体中合成淀粉,暂时贮存起来。叶片在光下一段时间后,可以用碘检测到淀粉的存在。
呼吸作用最常利用的底物是葡萄糖,淀粉、糖元必须水解成葡萄糖或磷酸葡萄糖后才能被呼吸作用利用。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com