

题目列表(包括答案和解析)
4. 用惰性电极电解100mL饱和食盐水,一段时间后,在阴极得到112mL H2(标准状况),此时电解质溶液(体积变化忽略不计)的pH为 ( )
A. 13 B. 12 C. 8 D. 1
3. 化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.电解饱和食盐水时,阳极的电极反应式为:2Cl - -2e -==Cl2 ↑
B.氢氧燃料电池的负极反应式:O2 + 2H2O + 4e- == 4OH -
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e- == Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e - == Fe2+
2. 铁棒与石墨棒用导线连接后浸入0.01mol•L-1的食盐溶液中,可能出现的现象是( )
A. 铁棒附近产生OH- B. 铁棒逐渐被腐蚀
C. 石墨棒上放出Cl2 D. 石墨棒上放出O2
1. 下列各变化中属于原电池反应的是( )
A.在空气中金属铝表面迅速氧化形成保护层
B.镀锌铁表面有划损时,也能阻止铁被氧化
C.红热的铁丝与冷水接触,表面形成蓝黑色保护层
D.浓硝酸比稀硝酸更能氧化金属铜
26.(8分)含有1.4 g某碱金属及其氧化物的混合物,跟水完全反应后,蒸干溶液得到不含结晶水的固体1.79 g,则该混合物中碱金属元素的质量分数为多少?
25.(6分)20℃时,碳酸钠和碳酸氢钠的溶液解度分别是21.5 g和9.6 g,向100 g 20℃的碳酸钠饱和溶液中通入足量二氧化碳,最多可得多少克晶体(温度保持20℃)?
24.(8分)已知30℃时几种盐的溶解度(g/100 g 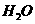 )
)
|
物质 |
 |
 |
  |
 |
 |
36.3 |
27.O |
11.1 |
41.1 |
1862年比利时索尔维以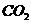 、
、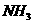 、水为原料制得纯净的
、水为原料制得纯净的 这种制碱法,叫索尔维法,其主要操作是:①在氨化的饱和
这种制碱法,叫索尔维法,其主要操作是:①在氨化的饱和 溶液中通入
溶液中通入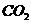 制得小苏打;②再把小苏打焙烧,制得纯碱,而副产物
制得小苏打;②再把小苏打焙烧,制得纯碱,而副产物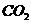 可循环使用;③在析出小苏打的母液中加入生石灰,逸出的
可循环使用;③在析出小苏打的母液中加入生石灰,逸出的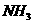 循环使用。
循环使用。
1943年我国著名化学家侯德榜先生,改进了“索尔维法”,用固体 代替生石灰加入母液中,使
代替生石灰加入母液中,使 晶体析出,生产纯碱和
晶体析出,生产纯碱和 ,这便是闻名世界的“侯氏制碱法”。
,这便是闻名世界的“侯氏制碱法”。
试回答:
 (1)写出在氨化的饱和
(1)写出在氨化的饱和 溶液中通过入
溶液中通过入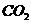 的化学方程式:
,该方法能制得小苏打的原因是
。
的化学方程式:
,该方法能制得小苏打的原因是
。
(2)不能在 溶液中先通入
溶液中先通入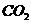 ,然后再通往
,然后再通往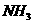 制得
制得 的原因是
的原因是
。
(3)在析出小苏打后的母液中加入生石灰发生反应的化学方程式为: 。
(4)“侯氏制碱法”的化学原理中涉及的化学反应类型有 。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(5)“两法”相比,侯氏制碱法的优点是 。
23.(5分)A、B、C、D都是钠的化合物,分别有以下化学变化。
 ==
==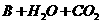
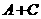 =
=
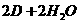 =
=

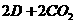 =
=
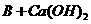 =
=

(1)写出A-D各物质的化学式
A. B. C. D. 。
(2)写出下列反应的化学方程式
A+C
;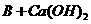 。
。
22.(7分)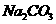 、
、 、
、 的固体混合物共4 g,把它们加强热到质量不再减轻,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生
的固体混合物共4 g,把它们加强热到质量不再减轻,冷却后称重为3.38 g。在残余固体中加入过量的盐酸,产生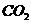 0.88 g。回答:
0.88 g。回答:
(1)固体质量减轻了
g,这是因为发生了 反应(写化学方程式),从化学方程式可计算出原混合物中 的质量是 g,加热后新增加了
的质量是 g,加热后新增加了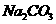 g。
g。
(2)残余固体中加入过量盐酸的化学方程式是 ,通过已知
条件“产生的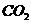 为O.88 g”可以计算出参加反应的
为O.88 g”可以计算出参加反应的 是 g,因
是 g,因
为其中有 g  是加热
是加热 产生的,故原混合物中含
产生的,故原混合物中含
g。
(3)原混合物中含 g。
g。
21. (6分)4 g 放入 g水中才能使溶液的质量分数为8%。4.6 g钠放入 g水中,才能使溶液溶质的质量分数为8%。7.8 g
放入 g水中才能使溶液的质量分数为8%。4.6 g钠放入 g水中,才能使溶液溶质的质量分数为8%。7.8 g 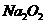 放入 g水在才能使所得溶液溶质质量分数为8%。
放入 g水在才能使所得溶液溶质质量分数为8%。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com