
题目列表(包括答案和解析)
24.
 (10分)已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(10分)已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素。
(1)若A为固体单质,则①D的分子式为 ,
② C→E的化学方程式为
③ 将E通入某些单质的溶液中,可发生反应生成两种强酸,试举一例
写出化学方程式 。
(2)若A为气体单质,则
① D→C的化学方程式
② C→E的离子方程式为 。
23. (6分)A、B两种气体组成的混合气体(相对分子质量A大于B),只含氮氢两种元素。不论A、B以何种比例混合,混合气体中氮氢两种元素的质量比始终大于14∶3,则A为 ,B为_ (填化学式)。若混合气体中氮氢两元素的质量之比为14∶1,则混合气体中A、B的物质的量之比为 。
22. (8分) 某学生课外活动小组利用右图所示装置分别做如下实验:
(8分) 某学生课外活动小组利用右图所示装置分别做如下实验:
⑴在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢 复
红色,则原溶液可能是________________溶液;加热时溶液由红色逐渐变
浅的原因是:________ _______
⑵在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
________________溶液;加热时溶液由无色变为红色的原因是:
______________________________________________________________________________。
21.(8分)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。已知水是反应产物之一。
(1)该反应中的还原剂是________________;(2)该反应中的还原产物是_______________;
(3)写出该反应的化学方程式并标出电子转移方向和数目:
;
(4)若反应过程中转移了0.3 mol电子,则生成水的质量是______________。
20.为了除去NO、NO2、N2O4对大气的污染,常采用氢氧化钠溶液进行吸收处理(反应方程式:3NO2 + 2NaOH→2NaNO3 + NO + H2O; 2NO2 ≒N2O4 ;NO2 + NO + 2NaOH→2NaNO2)。现有由a mol NO、b mol NO2、c mol N2O4组成的混合气体恰好被V L氢氧化钠溶液吸收(无气体剩余),则此氢氧化钠溶液的物质的量浓度最小为
A.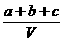 mol/L
B.
mol/L
B. mol/L
mol/L
 C.
C. mol/L
D.
mol/L
D. mol/L
mol/L
姓名___________ 成绩___________
19.某学生配制浓硫酸和浓硝酸的混和酸液,将浓硫酸较快地加入到浓硝酸中时,在容器口产生大量的白雾,跟解释这一现象无关的叙述是
A.浓硫酸具有强氧化性 B.硝酸具有挥发性
C.硝酸蒸气容易吸收空气中的水蒸气 D.浓硫酸与水作用放出大量的热
18.将0.1 mol 铜与40 mL 10 mol·L-1HNO3充分反应后,溶液中含a mol H+,由此可知
A.生成的气体在标准状况下的体积为4.48 L
B.生成的气体在标准状况下的体积为1.49 L
C.被还原的硝酸的物质的量为(0.2-a) mol
D.反应后溶液中所含NO3-的物质的量为0.2 mol
17. 检验某溶液中是否会有NO3 时,下列方法正确的是
时,下列方法正确的是
A. 加浓H2SO4与Cu片后共热 B. 加热蒸干后再加浓硫酸与铜片
C. 加热浓缩后与浓H2SO4、Cu片共热 D. 加入NaOH溶液,加热
15. 用以下三种途径来制取相同质量的硝酸铜:1铜与浓硝酸反应;2铜与稀硝酸反应;3铜与氧气反应生成CuO,CuO再与稀硝酸反应。下列有关叙述不正确的是
A. 所消耗的硝酸的量:①>②>③
B.对环境造成的危害,③最小
C.因铜与浓硝酸作用最快,故制取硝酸铜的最佳方案是①
D.三种途径所消耗的铜的质量相等
16.铜和镁的合金4.6克完全溶于浓硝酸中,若反应中硝酸被还原只产生4480mL的NO2气和336mL的N2O4气体(都已折算成标况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为
A. 9.02g B. 8.51g C. 8.26g D. 7.04g
14. 将3.5g Fe、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL,若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称得质量为8.6g,则收集到的气体体积V值可能为
将3.5g Fe、Mg合金投入到一定量的硝酸中,金属与硝酸恰好完全反应,共收集到标准状况下的气体VL,若向反应后的溶液中加入足量的氢氧化钠溶液,待金属元素全部沉淀后,再将沉淀过滤、洗净、干燥后称得质量为8.6g,则收集到的气体体积V值可能为
A.1.12 B.5.34 C.6.72 D.8.23
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com