
题目列表(包括答案和解析)
7、将某溶液滴入Fe(OH)3胶体内,开始时有沉淀生成,继续滴加沉淀消失,这种液体是:
A.2mol/LH2SO4溶液 B.2mol/LNaOH溶液
C. 2mol/LMgSO4溶液 D.硅酸溶胶
6、标准状况下一个空瓶的质量是20g,装满O2,称量其质量为21g,若装满A气体,称量其质量为22g,则A的相对分子质量是
A、16 B、32 C、64 D、128
5、标准状况下,14g某气体的分子数与14gCO的分子数相等,则该气体的密度是
A、11.6g/L B、1.16g/L C、12.5g/L D、1.25g/L
4、某溶液中含有大量的Cl-、SO42-、 OH-等三种阴离子,如果只取一次该溶液就能够分别将3种粒子依次检验出来,下列实验操作顺序正确的是①过滤、②滴加AgNO3溶液、③滴加Mg(NO3)2溶液、④滴加Ba(NO3)2溶液
A、③①②①④ B、②①③①④ C、④①③①② D、②①④①③
3、三种正盐的混合溶液中含有0.2 molNa+ 、0.25molMg2+、0.4mol Cl-,则SO42-离子的物质的量为
A、0.1 mol B、0.3 mol C、0.5mol D、0.15mol
2、有15gA物质和10.5gB物质完全反应后,生成7.2gC物质,1.8gD物质和0.3 mol E物质。则E的摩尔质量是
A、100g/mol B、111 g/mol C、55 g/mol D、27.5g/mol
1、下列说法正确的是
A、1 mol O2和1 mol N2所占有的体积都约是22.4L
B、H2的气体摩尔体积约为22.4L
C、在标准状况下,1 mol H2和1mol H2O所占的体积都约是22.4L
D、在标准状况下,22.4L由N2和N2O组成的混合气体中,所含有的氮原子的物质的量2mol
28.实验室电解50 ml饱和氯化钠溶液,标准状况下收集到氯气的体积为2.688L,求生成溶液的物质的量浓度?(假定溶液体积不变)
福州八中2009-2010学年第一学期期中考试
27.(8分)要配制0.300 moL/L的稀H2SO4 500 mL
(1)若使用18.0 mol/L的浓H2SO4来配制时,所需浓硫酸的体积V为____ mL。
(2)下面是某同学配制稀H2SO4的过程:①用100 mL量筒取浓H2SO4 ②另取一量筒加入适量蒸馏水,然后将V mL浓H2SO4缓慢倒入此量筒中稀释 ③将稀释后的浓H2SO4经冷却直接倒入500 mL的容量瓶中,用蒸馏水将烧杯内壁洗涤2~3次,并将每次的洗涤液注入容量瓶中,摇匀溶液 ④向容量瓶中加蒸馏水至离刻度线1~2 cm处 ⑤用胶头滴管加水至凹液面与刻度线相切,盖好瓶塞,摇匀 ⑥将配好的0.300 moL/L的H2SO4立即倒入干燥的试剂瓶中 ⑦在试剂瓶上贴好标签
其中错误的操作有(填序号) :
(3)现给出下列仪器(配制过程中可能用到):①100 mL量筒 ②10 mL量筒 ③烧杯 ④托盘天平 ⑤500 mL容量瓶 ⑥胶头滴管 ⑦玻璃棒。按实验时使用仪器的先后顺序,排列正确的是
A.②⑥③⑦⑤⑥ B.②③⑦⑤⑥
C.①③⑤⑦④⑥ D.④⑦③⑤⑥
(4)若实验遇到下列情况,其中会造成硫酸溶液的物质的量浓度偏低的是
①稀释浓硫酸后的烧杯未洗涤 ②未经冷却趁热将溶液注入容量瓶中
③摇匀后发现液面低于刻度线而没有再加水 ④容量瓶中原有少量蒸馏水
⑤定容时仰视刻度线 ⑥洗涤量取浓硫酸后的量筒,并将洗涤液也转移入容量瓶
26.(14分)
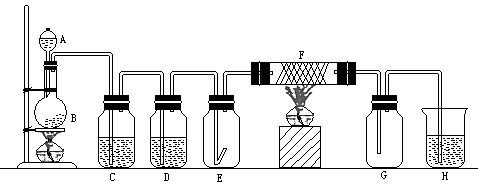
Ⅰ.(6分)下图是制取纯净,干燥的Cl2并进行有关Cl2性质实验的装置,装置中的C、 D瓶均为洗气瓶,E瓶中放有干燥的红布条;F管中有铜丝;G瓶为集气瓶;H为尾气吸收装置.
|
试回答:
(1)装置①发生反应的化学方程式为 。
(2)C中的试剂是 ,作用是 ;D中的试剂是 ;作用是 。
Ⅱ.(8分)已知Cl2+H2O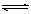 HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
HCl+HClO。为了探究HClO的漂白性,某同学设计了如下的实验。
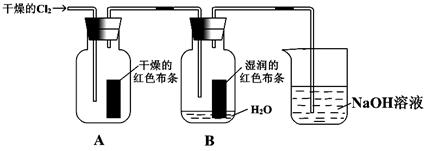
(1)通入Cl2后,从集气瓶A中干燥的红色布条的现象可得出的结论是 ;
从集气瓶B中湿润的红色布条的现象可得出的结论是 。
(2)为了确认是HClO使湿润的红色布条褪色,你认为还应增加的实验是 。
(3)烧杯中发生反应的化学方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com