

题目列表(包括答案和解析)
32、(7分)一定量的氢气在氯气中燃烧,所得混合物用100 mL 3.00 mol/L的NaOH溶液(密度为1.12 g/mL)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500 mol。
⑴所得溶液中Cl-的物质的量为 mol。
(2)所用氯气和参加反应的氢气的物质的量之比n(Cl2):n(H2)= 。
杭州学军中学2009学年上学期期中考试高一化学
31、(4分)实验室用 17.4g MnO2与足量的浓度为12mol/L的浓盐酸反应制取氯气。
(1)理论上被氧化的HCl的物质的量为多少?
(2) 若将反应后的溶液配制成500mL溶液,则该溶液中MnCl2的物质的量浓度是多少?
30、(13分)请利用下列装置及试剂组装一套装置。其流程是:先制取纯净干燥的Cl2(不收集),后探究HClO的漂白性。
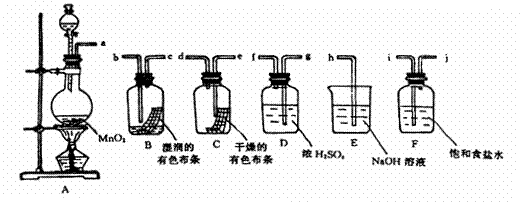

(1)欲制备纯净干燥的氯气(不收集),按气体从左向右流向将各装置依次连接起来(填接口标号): a 接 , 接 。其中烧瓶中发生反应的化学方程式是 。
(2)为探究并确证HClO的漂白性,将以上所制干燥纯净的氯气继续依次通过 、 装置,发生反应的化学方程式是 。某同学认为,还需增加一个实验,才可确证是HClO具有漂白性。请你帮他设计增加的实验 。
(3)E装置的作用 。
(4) 用滴管把新制的氯水逐滴加到含有酚酞的氢氧化钠溶液中,当加到最后一滴时,溶液的红色
突然消失。发生这一现象的原因可能有两个:
①是由于 (用简要文字说明)
②是由于 (用简要文字说明)
简述用实验方法证明褪色的原因是①还是②
。
29、(10分)实验室配制480ml 0.1 mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取十水碳酸钠晶体________g。
(2)配制时应除选用托盘天平、药匙、烧杯、玻璃棒外,还需要用到的仪器有 。
(3)容量瓶上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中
的 。(填数字符号)
(4)若实验时遇到下列情况,将使溶液的浓度偏低的是 。
A、忘记将洗涤液转入容量瓶; B、容量瓶洗涤后内壁有水珠而未作干燥处理;
C、定容、摇匀、静置后发现凹面低于刻度线又加水至刻度线;
D、定容时俯视刻度线;
28、(6分)许多元素有多种核素,而且在自然界中各种核素有固定的原子分数。如氧元素存在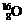 、
、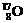 、
、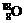 三种核素,氢元素有
三种核素,氢元素有 、
、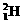 、
、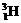 三种核素。
三种核素。
(1)现有11.0g
由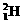 和
和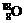 组成的水分子,其中含中子数为 mol,电子数为 mol。
组成的水分子,其中含中子数为 mol,电子数为 mol。
(2)请画出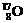 2-微粒的结构示意图:
。
2-微粒的结构示意图:
。
27、(6分)
已知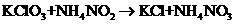
(1)指出以上反应中的氧化剂是 被氧化的元素是
(2)配平上述反应方程式并用双线桥标明电子转移的方向和数目
26、(4分)现有以下物质①NaCl溶液 ②干冰 ③Na2O固体 ④铜 ⑤BaSO4固体 ⑥蔗糖 ⑦液态HCl ⑧熔融状态的KNO3,其中属于电解质的是: ,该状态下能导电的是________________(填序号)。
25、从矿物学资料查得,一定条件下自然界存在如下反应:(其中FeS2中的S为-1价,Cu2S中的S为-2价) 14CuSO4+5FeS2+12H2O====7Cu2S+5FeSO4+12H2SO4.下列说法正确的是
A、Cu2S既是氧化产物又是还原产物
B、5molFeS2发生反应,有10mol电子转移
C、产物中的SO42-离子有一部分是氧化产物
D、FeS2只作还原剂
24、ClO2是一种广谱型的消毒剂,根据世界环保联盟的要求ClO2将取代Cl2成为生产自来水的消毒
剂。工业上的ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,在以上反应中NaClO3和Na2SO3的物质的量之比为
A、1∶1 B、2∶1 C、1∶2 D、3∶2
23、已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性强弱的顺序为:
Cl-< Fe2+< H2O2< I-< SO2,则下列反应不能发生的是
A、2Fe3++SO2+2H2O = 2Fe2++SO42-+4H+
B、SO2+ I2+2H2O = 2HI+H2SO4
C、H2O2+ H2SO4= SO2+ O2 + 2H2O
D、2Fe3++2I- = 2Fe2++ I2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com