
题目列表(包括答案和解析)
2. 在NaCl、Cl2、( )、NaClO2、NaClO3的排列中,括号内填入的物质的化学式应为
A.NaClO4 B.HCl C.NaClO D.ClO2
1.在盛放浓硫酸的试剂瓶的标签上应印有下列警示标记中的 ( )

24.(8分)(1)用48.3g Na2SO4·10H2O配制成500mL溶液,其物质的量浓度为: mol/L。若从中取出10mL,含溶质质量为 g。
(2)若将这10mL溶液用水稀释到100mL,所得溶液中Na+的物质的量浓度为 mol/L。若将该溶液中的SO42-全部沉淀下来,至少需要加入0.1mol/L的BaCl2溶液 mL。
23.(12分)为除去粗盐中的Ca2+、Mg2+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量)
 (1)判断BaCl2已过量的方法是
。
(1)判断BaCl2已过量的方法是
。
 (2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
(2)第④步中,写出相应的化学方程式(设粗盐溶液中Ca2+的主要存在形式为CaCl2)
。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是
。
(4)为检验精盐纯度,需配制250 mL 0.2 mol/L NaCl(精盐)溶液,题图是该同学转移溶液的示意图,图中的错误是
。
22.(13分)实验室用密度为1.18g/mL,质量分数为36.5%浓盐酸配制250mL0.1mol/L的盐酸溶液,填空并请回答下列问题:
(1)需要使用的仪器除量筒、烧杯、玻璃棒外,还要 。(2分)
(2)根据计算,需要上述36.5%浓盐酸 mL。(2分)
(3)配制时,其正确的操作顺序是(每个字母只能用一次)A G (2分)
A.使用容量瓶前检查它是否漏水
B.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
C.用量筒量准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其混合均匀
D.将已冷却的盐酸沿玻璃棒注入250mL的容量瓶中
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,摇匀。
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处,改用胶头滴管加水,使溶液凹面恰好与刻度相切
G.将配好的溶液转入试剂瓶中,贴好标签注明所配溶液的名称及浓度,以便存放。
(4)操作A中,将洗涤液都移入容量瓶,其目的是:
。(2分)
(5)若出现如下情况,对所配溶液浓度将有何影响? (偏高、偏低或无影响)(4分)
A.用量筒量取浓盐酸时俯视刻度线: ;
B.定容时仰视容量瓶刻度标线: ;
C.容量瓶未经干燥即使用: ;
D.将未冷却至室温的盐酸沿玻璃棒注入250mL的容量瓶中: 。
(6)若实验过程中,加蒸馏水时不慎超过了刻度如下情况如何处理? (1分)
。
21.(7分)用双线桥表示电子转移的方向和数目,并完成填空
2KMnO4 + 16HCl(浓)= 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O
该反应中氧化剂 还原剂 氧化产物 还原产物
反应中若有71克Cl2生成,则被氧化的HCl质量为 克。
20.(10分)有一包白色固体,可能是NaCL、K2CO3、Na2SO4和BaCL2中的一种或几种。将此白色固体溶解于水时,有白色沉淀生成,过滤后,滤液为无色。
①将部分沉淀移入试管中,加入稀硝酸,沉淀溶解完全,且有气体生成。
②在滤液中滴入几滴AgNO3溶液,有白色沉淀生成,再加入稀硝酸,沉淀不溶解。

 ⑴通过上述实验现象分析:该白色固体中一定含有的物质为
, 不可能含有的物质为
。
⑴通过上述实验现象分析:该白色固体中一定含有的物质为
, 不可能含有的物质为
。
⑵试写出有关反应的离子方程式:
①
②
③
19.(6分)有以下几种物质
①乙醇 ②MgCl2晶体 ③蔗糖 ④铜 ⑤食盐水 ⑥BaSO4
请填空回答(填序号)。
(1)以上物质中能导电的是 ;
(2)以上物质中属于电解质的是 ;
(3)以上物质中属于非电解质的是 。
18.V mLAl2(SO4)3溶液中含有Al3+a g,取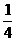 V mL溶液稀释到4V mL,则稀释后溶液中S04的物质的量浓度是( )
V mL溶液稀释到4V mL,则稀释后溶液中S04的物质的量浓度是( )
A. mol/L
B.
mol/L
B. mol/L C.
mol/L C. mol/L
D.
mol/L
D. mol/L
mol/L
17.给出下列条件,无法确定该物质摩尔质量的是( )
A.已知气体在标准状况时的密度
B.已知物质的体积和质量
C.已知一定量物质的质量和物质的量
D.已知物质一个分子的实际质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com