
题目列表(包括答案和解析)
30、(8分)取100mL的Na2CO3和Na2SO4混合溶液,加入 100 mL Ba(OH)2溶液后,恰好完全沉淀,过滤、干燥后得到14.51g白色沉淀和滤液,再用过量稀硝酸处理沉淀,最后剩余4.66g,并有气体放出。计算:[请写出计算过程]
(1)原混合液中Na2SO4的物质的量 (2)产生的气体在标准状况下的体积;
(3)过滤出沉淀后,计算所得滤液的物质的量浓度(反应前后溶液体积变化忽略不计)。
29、在实验室里可用下图所示装置制取氯酸钾和探究氯水的性质。

① ② ③ ④
图中:①为实验室制氯气发生装置;②的试管里盛有15 mL 30% KOH溶液,并置于水浴中;③的试管里加有紫色石蕊试液④为尾气吸收装置。
请填写下列空白:
(1) 烧瓶中反应的离子反应方程式
(2) 实验时为了除去所制氯气中的氯化氢气体,可在①与②之间安装盛有_______
A.碱石灰 B.饱和食盐水 C.浓硫酸 D.饱和碳酸氢钠溶液
(3)若用足量的二氧化锰和10ml 12mol/L的HCl反应,所以的氯气远小于0.06mol,其原因之一是浓盐酸的挥发性,另一个主要影响因素是
(4)实验中, ③的试管里溶液最后呈现为无色透明,真正起漂白作用的微粒是
(5) ②的试管发生氧化还原反应得氯酸钾和KCl,若反应所得产物中有0.1mol得氯酸钾,则同时还应该生成的KCl的物质的量为
28、(8分)实验室用2mol/L的NaOH浓溶液配制100mL 0.2mol·L-1的NaOH溶液,试回答下列问题:
(1)除下列仪器:A.量筒 B.烧杯 C.胶头滴管,还缺少的主要玻璃仪器为:
(2)配制时,应用量筒量取 mL该浓溶液。配制时可分为以下几个步骤:①量取 ②计算 ③洗涤 ④冷却⑤转移 ⑥稀释⑦定容。其正确的操作顺序为________。(每步操作只用一次)
(3) 配制完毕后,教师指出有四位同学各进行了下列某一项错误操作,你认为这四项错误操作中哪一项会导致所得溶液浓度偏高
A、定容时仰视容量瓶刻度线
B、将冷却后的溶液转移入容量瓶,然后进行定容操作
C、定容时俯视容量瓶刻度线
D、定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处
27、 (12分)已知物质A~I之间的转化关系符合下图所示。其中A、C、F、G、I为常见固体且其焰色反应均为黄色;B常温下为液体;其余物质通常况下均为气体。

试回答下列问题:
(1)写出下列物质的化学式:A__________D________,F__________
(2)完成下列式子:
反应②的离子反应方程式___________________ _________________;
反应③的化学反应方程式______ __________________。
(3)1molE最多可以制得漂白粉的质量为 g
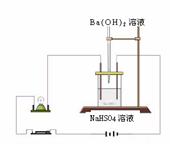
26、(6分)(1)右图是用一定量的NaHSO4溶液进行导电性实验,发现灯泡较亮。向其中逐滴滴入Ba(OH)2溶液直至过量,观察的现象是:
(2)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:__________________ ________
25、(8分)实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)从化学方程式得知,氧化性最强的物质是 ,氧化产物是
 (2)若被氧化的HCl为0.1mol,则生成的氯气体积(标况下)为
升。
(2)若被氧化的HCl为0.1mol,则生成的氯气体积(标况下)为
升。
(3)氢化亚铜(CuH)是一种难溶的物质, 能在氯气中完全燃烧,反应中氧化剂和还原剂的物质量之比
24、由一种阳离子与两种酸根离子组成的盐称为混盐。混盐漂白粉(CaOCl2)在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断一定不正确的是
A、该混盐中的氯元素的化合价为+l和-1 B、该混盐可溶于水
C、该混盐水溶液加入硝酸银会出现浑浊
D、该混盐与硫酸反应产生1mo1 Cl2时转移2NA个电子
23、在金属焊接和切割过程,常能闻到一股鱼腥臭味。经检测,那是电弧产生的臭氧的气味。臭氧具有很强的氧化性,可使湿润的KI-淀粉试纸变蓝色,某有关反应的化学方程式为:O3+2KI+H2O 2KOH+I2+O2,对此反应,下列说法正确的是
2KOH+I2+O2,对此反应,下列说法正确的是
A、在此反应中O3是氧化剂,O2是还原产物
B、被还原的氧原子与被氧化的I-的个数比为1:2
C、反应中1mol O3参加反应,转移的电子为6mol
D、由此反应可知,氧化性强弱关系为: I2 > O3
22、某地有甲、乙两工厂排放污水,污水中各含有下列8种离子中的4种(两厂不含相同离子):Ag+、Ba2+、Fe2+、Na+、Cl-、SO42-、NO3-、OH-。若两厂单独排放都会造成严重的水污染,如将两厂的污水按一定比例混合,沉淀后污水便变成无色澄清只含硝酸钠而排放,污染程度会大大降低。关于污染源的分析,你认为正确的是
A、Na+ 和NO3- 来自同一工厂 B、Cl- 和NO3- 一定在同一工厂
C、Ag+ 和Na+ 可能在同一工厂 D、SO42- 和OH - 来自同一工厂
21、某溶液中Cl-、Br-、I-三者物质的量之比是1:2:3,通入一定量的Cl2,当反应完成后,该比值变为3:2:1,则反应的Cl2与原溶液中I-的物质的量之比是 A、 1:2 B、 1:4 C、 1:3 D、 1:6
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com