
题目列表(包括答案和解析)
7. 下列化学实验基本操作正确的是( )
A.称量前用游码来调节天平平衡
B.加热时,应把受热物质放在内焰部位
C.使用试管夹时,应将试管夹从试管底部往上套,夹在试管的中上部
D.给试管内液体加热时,液体体积不应超过试管容积的2/3
6. 下列溶液在指定环境中能大量共存的是( )
A.有大量CO32-溶液中:Na+、NH4+、SO42-、NO3-
B.强碱性溶液中:NH4+、Ca2+、NO3-、Cl-
C.强酸性溶液中:Cu2+、Mg2+、HCO3-、SO42-
D.有大量Ba2+溶液中:K+、Ca2+、CO32-、SO32-
5. 下列关于碱金属的原子结构和性质的叙述不正确的是( )
A.碱金属最外层都只有一个电子,在化学反应中容易失去
B.都能在O2中燃烧生成过氧化物
C.都是强还原剂
D.都能与水反应生成碱
4. ClO2是一种消毒剂,实验室可通过以下反应制得ClO2:
2KClO3 + H2C2O4
+ H2SO4 2ClO2↑+ K2SO4
+ 2CO2↑+ 2H2O
2ClO2↑+ K2SO4
+ 2CO2↑+ 2H2O
下列说法正确的是( )
A.KClO3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被还原 D.每生成一个ClO2分子则反应中转移2个电子
3. 根据下列方程式判断下列微粒的氧化性顺序按由强到弱顺序排列的是( )
2Fe2++ Cl2 = 2Fe3++ 2Cl-;2Fe3++ 2I-= 2Fe2++ I2;I2 + SO2 + 2H2O = 4H++ 2I-+ SO42-
A.Cl2 > Fe3+> I2 > SO2 B.Fe3+> I2 > SO2 > Cl2
C.I2 > Cl2 > Fe3+> SO2 D.Cl2 > SO2 > I2 > Fe3+
2. 关于化学反应下列说法错误的是( )
A.化学反应一定有新物质生成 B.化学反应一定有能量变化
C.化学反应一定有元素化合价的变化 D.化学反应一定遵循质量守恒定律
1. 能源短缺和环境污染是当今社会两大问题,下列有关说法你认为正确的是( )
A.建立宜居重庆,森林城市一定要严禁使用化石燃料
B.大力发展火电可解决重庆缺电状况
C.在汽车等交通工具上使用氢燃料或混合燃料成本太高,不宜推广
D.将煤脱硫、粉碎或气化后进行燃烧既可降低环境污染,也可提高燃烧效率
31.(8分)标准状况下,将V升HCl气体溶于水配成0.5L溶液,其密度为1.2g/cm3 ,溶质的质量分数为36.5%,将此溶液与一定量MnO2混合加热,消耗MnO2 43.5g,求:
(1)此盐酸的物质的量浓度。
(2)此时反应中被氧化HCl的物质的量。
(3)向反应后溶液中加入足量AgNO3溶液,可得沉淀多少g?
瑞安中学2009学年第一学期高一年级期中考试
30. (10分)用18mol·L-1浓硫酸配制100mL3.0mol·L-1稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积 ②量取一定体积的浓硫酸
③溶解 ④转移、洗涤 ⑤定容 ⑥摇匀
完成下列问题:
(1)所需浓硫酸的体积是 mL,量取浓硫酸所用的量筒的规格是 。
(从下列中选用:A.10mL B.25mL C.50mL D.100mL).
(2)写出第⑤步实验的具体操作过程 。
(3)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
①容量瓶用蒸馏水洗涤后残留有少量的水: ;
②溶解过后立即转移溶液: ;
③定容时仰视刻度线: ;
(4)将正确配制的上述溶液取出10mL,其浓度为 ;将此10mL溶液稀释至1L,则硫酸电离出的H+数目为 .
29.(9分)(1)已知氢元素有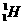 、
、 、
、 三种核素,氧元素也有
三种核素,氧元素也有 、
、 、
、 三种核素,则它们所形成的水分子共有 种。
三种核素,则它们所形成的水分子共有 种。
(2)无土栽培中,需配制一定组成的植物营养液。已知某植物营养液的配方为0.3molKCl、0.2molK2SO4、0.1molZnSO4和1LH2O 。若以KCl、K2SO4、ZnCl2和H2O为原料配制,需要下列各种物质的物质的量分别为:①n(K2SO4)= ②n(H2O)= 。
(3)同温同压下,相同质量的SO3气体和SO2气体 ,物质的量之比为 ,含氧元素的质量之比为 ,SO3对SO2的相对密度为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com