
题目列表(包括答案和解析)
18.(12分)海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验:
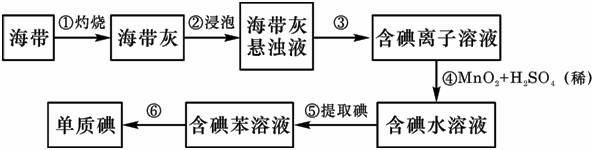
请填写下列空白:
(1)(3分)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是 B、D、E (从下列仪器中选出所需的仪器,用标号字母填写在空白处)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)(4分)步骤③的实验操作名称是 过滤 ;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是 蒸馏 。
(3)(2分)步骤⑤中,某学生选择用苯来提取碘的理由是苯与水互不相溶;碘在苯中的溶解度比在水中大。
(4)(3分)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:取少量提取碘后的水溶液于试管中,加入几滴淀粉试液;观察是否出现蓝色(如果变蓝,说明还有单质碘)。
17. (7分)右图所示装置有多种用途,请回答下列问题:
(7分)右图所示装置有多种用途,请回答下列问题:
(1)洗气:除去CO中的水蒸气,装置内应盛放浓硫酸;
(2)检验:证明CO中混有CO2,装置内应盛放澄清石灰水;
(3)集气:若用排空气法收集比空气密度小的气体时,气体应从装置的 B 端通入(填“A”或“B”,下同);若收集比空气密度大的气体,则气体从 A端通入。若用排水法收集O2时,瓶内应先装满水,气体从 B 端通人。
(4)贮气:若要用水将装置中的氧气排出进行实验时,水应从 A 端通人。
(5)量气:若要测定实验室制得的少量O2的体积,则应在瓶内先装满水,再将O2从 B 端通入。
16.(5分)分离和提纯下列混合物,将合理的方法填入下列空格内:
|
序号 |
混合物 |
方法 |
|
1 |
海水中提取饮用水 |
蒸馏 |
|
2 |
提取碘水中的碘 |
萃取 |
|
3 |
 从含少量氯化钠的硝酸钾溶液中提取硝酸钾 从含少量氯化钠的硝酸钾溶液中提取硝酸钾 |
结晶 |
|
4 |
从KNO3溶液中分离AgCl颗粒; |
过滤 |
|
5 |
除去生石灰中混有少量的碳酸钙 |
灼烧 |
15.(6分)下面是用碳酸钠固体配制250 mL0.05 mol/L碳酸钠溶液的操作,请按要求填空:
(1)所需碳酸钠的质量为1.3g;
(2)把称量好的药品放在小烧杯中,用适量蒸馏水进行溶解,并不断搅拌,目的是加速溶解;
(3)冷却后,将上述溶液用玻璃棒引流,转移到容量瓶中,并用蒸馏水洗涤烧杯和玻璃棒2-3次,洗涤液要转移到容量瓶中,并摇匀。若不洗涤,所配的溶液的浓度将偏低(填偏高、偏低、无影响);
(4)加水至距刻度线1-2cm处,改用胶头滴管加水,使溶液的凹液面正好跟刻度线水平相切。若加水超过刻度线,应该重新配制。
14.(4分)12.4gNa2R中Na+ 为0.4 mol,则Na2R的摩尔质量为62g·mol-1,R的相对原子质量为 16 。
13.(10分)用20.0g烧碱配制成500mL溶液,其物质的量浓度为 1 mol·L-1;从中取出10mL,其物质的量浓度为 1 mol·L-1,这10mL中含溶质 0.4 g。若将这10mL溶液用水稀释到100mL,所得溶液中溶质的物质的量浓度为 0.1 mol/L,其中含Na+的质量是 0.23g 。
12. 20℃时,NaCl的溶解度为36g,此时NaCl饱和溶液的密度为1.12g/cm3 ,在此温度下,NaCl饱和溶液中NaCl的物质的量浓度为 ( )
A.0.15mol·L -1 B.1.36mol·L -1 C.5.07mol·L -1 D.6.15mol·L -1
11.下列溶液中,跟100mL 0.5mol·L -1NaCl溶液所含的Cl-物质的量浓度相同的是( )
A.100mL0.5mol·L-1MgCl2溶液 B.200mL1mol·L-1CaCl2溶液
C.50mL1mol·L-1NaCl溶液 D.25mL0.5mol·L-1HCl溶液
10. 配制100mL1.0mol·L-1的NaOH溶液,下列情况会导致溶液浓度偏高的是( )
A.容量瓶使用前有少量蒸馏水
B.配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C.在转移过程中有溶液撒在外面
D.俯视确定凹液面与刻度线相切
9. 关于配制NaCl溶液的叙述不正确的是( )
 A.托盘天平称取58.50克食盐,加水配制成1升溶液,NaCl溶液浓度为1mol·L-1
A.托盘天平称取58.50克食盐,加水配制成1升溶液,NaCl溶液浓度为1mol·L-1
B.转移时,要用玻璃棒引流
C.溶解食盐的烧杯要洗涤2-3次并将洗涤液转移到容量瓶中
D.搅拌可加速溶解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com