
题目列表(包括答案和解析)
18.[全解]
设混合物中Fe的物质的量为x,Fe2O3的物质的量为y,反应生成H2需Fe的物质的量为a
Fe - H2
1mol 22.4L
a 0.224L a=0.01mol
Fe2O3 - 2Fe3+ - Fe
1mol 1mol
y (x-0.01mol)
 y= x-0.01mol
y= x-0.01mol
2x+2y·2=0.1L·2mol/L (Cl元素守恒)
解得:x=0.04mol
y=0.03 mol
(其他正确解答参照给分)

17.(1)Al2O3 2Al+Fe2O3=2Fe+ Al2O3
(2)Fe2++2OH-== Fe(OH)2↓ 4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3,白色沉淀逐渐变为灰绿色最后变为红褐色。
[说明]由①既能与酸又能与碱反应,且①电解可得O2可推知①为Al2O3。由⑦能与酸反应放出H2可推知⑦可能为金属,再由⑨能与O2反应说明⑨中金属元素具有可变化合价,所以该金属为铁的可能性最大,带入验证铁符合。
[点评] 本题是一道框图推断题,框图推断题是高考常见题型。本题综合考查了铝的三角转化和铁的三角转化;两者区别在于前者为复分解反应,后者为氧化还原反应;两者的联系为铝热反应。要解决好这一类问题,首先要熟练掌握常见物质的相互转化关系,其次是掌握必要的解题方法,如:1、善于寻找解题的“突破口” (1)从物质的组成结构方面寻找(2)从实验现象寻找(3)从典型的性质寻找(4)从反应的类型寻找(5)从反应条件寻找(无机反应)(6)从转化关系寻找等。2、善于总结常用方法(1)直觉思维法(2)寻找特征法(30顺推法(4)逆推法(5)猜想论证法(6)尝试法。
16.
(1)除去溶解在NaOH溶液中的O2,防止O2再进入
(2)保证溶液中不存在Fe3+
(3)A试管中溶液经导管压入B试管,因为生成的H2产生了压力,产生白色沉淀
[说明]本题解题关键在于如何保证Fe(OH)2不被氧化。
15.Cu Fe2+、Cu2+
[说明]因为c<a,所以Cu2+没有全部被还原,可知铁的投入量不足,所以滤渣只有单质铜,又因为2FeCl3+Cu=2FeCl2+CuCl2,可知滤液中不可能存在Fe3,所以滤液中只有Fe2+、Cu2+
14.(1)丙 (2)W3>W1>W2
[说明]有关方案的反应原理如下:

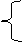 2Al+2OH-+2H2O==2AlO2-+3H2↑
2Al+6H+==2Al3++3H2↑
2Al+2OH-+2H2O==2AlO2-+3H2↑
2Al+6H+==2Al3++3H2↑
甲: 乙:
AlO2-+H++H2O== Al(OH)3↓ Al3++3OH-=Al(OH)3↓
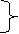
 2Al+6H+==2Al3++3H2↑
2Al+6H+==2Al3++3H2↑
 丙:
3AlO2-+Al3++6 H2O==4Al(OH)3↓ 2Al+2OH-+2H2O==2AlO2-+3H2↑
丙:
3AlO2-+Al3++6 H2O==4Al(OH)3↓ 2Al+2OH-+2H2O==2AlO2-+3H2↑

可设三种方案均制得4mol Al(OH)3,显然所用铝屑均为4mol。从上述反应原理可推知:
甲需4 mol OH-和4mol H+,乙需12mol OH-和12mol H+,丙需3mol OH-和3mol H+。由此可知:制取等质量的Al(OH)3,方案丙所用原料最少,方案乙所用原料最多。反之,方案丙制得的Al(OH)3最多,方案乙制得的Al(OH)3最多少。
13.OH- 、K十、C1-;铁粉,银;Ag十、Fe3+、C1-、OH-,KNO3
[说明] 甲厂的废水明显呈碱性,说明溶液中一定含有OH-,则Ag十、Fe3+只能存在于乙厂的废水中,而与Ag十、Fe3+能共存的阴离子只能为NO3-。所以甲厂的废水中存在OH- 、K十、C1-;乙厂的废水中Ag十、Fe3+、NO3--。
12.BC[说明] 等质量的Mg、Zn、Al与足量稀H2SO4反应,Zn产生的H2最少,Al产生的H2最多。利用极端假设法,假设金属全为Zn或Al以确定金属的取值范围。
11.B [说明] 混合液出现血红色说明有Fe(SCN)3生成,从而推知晶体中一定含有SCN-,Fe2+被Br2氧化为Fe3+ ,Fe3+的氧化性比Br2的氧化性弱。
10.BD[说明]反应中Cu+的化合价由+1价降低到0价的Cu,所以Cu2S、 Cu2O作为氧化剂。-2价的S化合价升高,所以Cu2S作为还原剂。SO2为氧化产物,Cu为还原产物,两者物质的量之比为1:6。
9.B[说明] Al2O3易熔于Na3AlF3的熔融体中。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com